我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业作出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、NH3和CO2为原料制得NaHCO3,进而生产出纯碱。相关的化学反应有:①NH3+CO2+H2O===NH4HCO3;②NH4HCO3+NaCl===NaHCO3↓+NH4Cl;③2NaHCO3 Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
方案1:分别将CO2和NH3通入到饱和食盐水中;
方案2:将CO2通入到含NH3的饱和食盐水中;
方案3:将NH3通入到含CO2的饱和食盐水中。
(1)经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处
________________________________________________________________________。
(2)根据方案2,某同学设计了如下实验步骤和装置图:
步骤1:配制含氨的饱和食盐水。在100 mL锥形瓶中加入20 mL氨水(体积比1∶1),再加入8 g食盐,塞紧橡皮塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水。
步骤2:制备NaHCO3。按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂制备NaHCO3。实验过程中,需要控制温度在30~35 ℃(大于35 ℃时NH4HCO3会分解)和CO2的通入速度(以出现能数得清的连续气泡为宜)。反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤。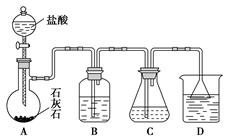
请回答下列问题:
①为控制反应温度在30~35 ℃,应采用的操作方法是________________________。
②装置B中的试剂是__________________,它的作用是__________________________。
③检验步骤2中所得晶体是NaHCO3而不是NaCl的实验方法和现象是
________________________________________________________________________
________________________________________________________________________。
④设计一个简单的实验方案证明Na2CO3溶液呈碱性是由CO32-引起的
________________________________________________________________________
________________________________________________________________________。