用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
E、定容时仰视刻度线
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体 L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体 g。
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g)△H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
Ⅰ、分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图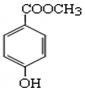
①下列对尼泊金酯的判断正确的是 。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.能与浓溴水反应产生白色沉淀。
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 。
(2)C8H8O3的另一种同分异构体甲如图: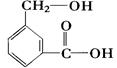
①请写出甲中所含官能团的名称 , 。
②甲在一定条件下跟Na反应的化学方程式是: 。
③甲跟NaHCO3溶液反应的化学方程式是: 。
Ⅱ、写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热: 。
(2)将CO2通入苯酚钠溶液中: 。
(3)1,3-丁二烯的与Br2的1、4加成反应: 。
(4)葡萄糖与银氨溶液发生银镜反应: 。
化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略如:加热等)
已知以下信息:
①A属于芳香烃,H属于酯类化合物。
②I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)B的结构简式 ,C的官能团名称 。
(2)B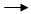 C;G
C;G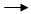 J两步的反应类型 , 。
J两步的反应类型 , 。
(3)①E+F H的化学方程式 。
H的化学方程式 。
②I G的化学方程式 。
G的化学方程式 。
(4)H的同系物K比H相对分子质量小28,K的同分异构体中能同时满足如下条件:
①属于芳香族化合物
②能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。
K的一个同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式 。
不饱和酯类化合物在药物、涂料等领域应用广泛。由炔烃直接制备不饱和酯的一种新方法如下:反应①
(1)下列有关化合物Ⅰ~Ⅲ的叙述中,正确的是_ __。
| A.化合物Ⅰ能使酸性高锰酸钾溶液和溴水褪色 |
| B.化合物Ⅰ、Ⅱ、Ⅲ都能发生取代反应、加成反应、消去反应和加聚反应 |
| C.化合物Ⅰ的所有碳原子可能都处于同一平面上 |
| D.1mol化合物Ⅲ最多能与4molNaOH反应 |
(2)化合物Ⅲ的分子式为__________,1mol该化合物最多能与_____molH2完全反应。
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,写出化合物Ⅳ结构简式___ (任写其中一种)
①能发生银镜反应,该化合物与银氨溶液反应的物质的量之比为1:4
②该化合物在与NaOH乙醇溶液共热能发生消去反应
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1
④该化合物遇到FeCl3溶液显紫色
(4)化合物Ⅴ是用于制备高聚物 涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
下图是一种合成 路线:
路线:
已知以下信息:
①有机化合物A可用来衡量一个国家石油化学工业发展水平。
②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
③
根据上述信息回答下列问题:
(1)A的结构式是 。
(2)B的结构简式为 。
(3)C生成D的化学方程式为 。
(4)反应Ⅱ的试剂是 ,该反应类型为 。
(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有 种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同”“不相同”)。