下列物质一定属于同系物的是 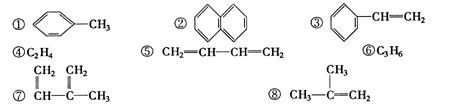
| A.④和⑧ | B.①、②和③ | C.⑤、⑦和⑧ | D.⑥和⑧ |
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为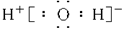 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.84gNaHCO3晶体中含有NA个CO32- |
| B.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA |
| C.标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D.理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为NA |
铁氧磁体法处理 的废水的原理可概述为:向
的废水的原理可概述为:向 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol 的废水至少需要加人amol FeSO4·7H2O。下列结论正确的是()
的废水至少需要加人amol FeSO4·7H2O。下列结论正确的是()
| A.x= 0.5 , a= 8 | B.x = 0.5 , a=10 | C.x = 1.5 , a= 8 | D.x = 1.5 , a= 10 |
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,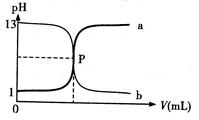
下列叙述正确的是()
A.盐酸的物质的量浓度为 1 mol/L |
B.P 点时反应恰好完全中和,溶液呈中性 |
| C.曲线 a 是盐酸滴定氢氧化钠的滴定曲线 | |
| D.酚酞不能用做本实验的指示剂 |
Al、Fe、Cu 都是重要的金属元素。下列说法正确的是()
| A.三种金属单质在常温下均可溶于浓硫酸 |
| B.三种金属单质放置在空气中均只能生成氧化物 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al. |
| D.制备AlCl3、FeCl3、CuCl2三种固体物质,均不能采用将溶液直接蒸干的方法 |