中国的饮食讲究“色香味”,颜色会影响消费。小李同学拟研发“绿色”食用色素,他以生长很快的入侵植物水葫芦为材料进行如下实验。
Ⅰ.提取叶绿素
Ⅱ.探究pH对叶绿素稳定性的影响
取一些叶绿素粗产品,配成一定浓度的溶液,于室温(约25 ℃)下进行实验,方法和结果如下表。
| 实验组号 |
叶绿素溶液(mL) |
调pH至 |
处理时间(min) |
溶液颜色 |
| ① |
3.0 |
Y |
10 |
绿色 |
| ② |
3.0 |
7.0 |
10 |
绿色 |
| ③ |
3.0 |
6.0 |
10 |
黄绿色 |
| ④ |
3.0 |
5.0 |
10 |
黄褐色 |
注:叶绿素被破坏后变成黄褐色。
根据所学知识和实验结果,请回答:
(1)提取食用叶绿素的X应该为________,原因是
________________________________________________________________________
________________________________________________________________________。
(2)表中Y应该为________,原因是
________________________________________________________________________
________________________________________________________________________。
(3)若用作食品色素,天然叶绿素色素不适用于________食品,否则
________________________________________________________________________。
(4)小李想了解叶绿素粗产品中是否含有其他色素,请你提供检测方法并写出主要步骤。
部分难溶物的颜色和常温下的Ksp如下表所示:
| Cu(OH)2 |
CuOH |
CuCl |
Cu2O |
|
| 颜色 |
蓝色 |
黄色 |
白色 |
砖红色 |
| Ksp(25 ℃) |
1.6×10-19 |
1.0×10-14 |
1.2×10-6 |
— |
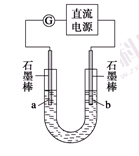
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是 。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。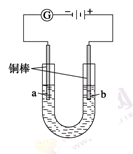
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是 ,原因是___________________________________________________________________________________。
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
阴离子膜法电解装置如下图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg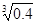 = -0.1 lg
= -0.1 lg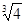 =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
| 开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
| 沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
已知重铬酸钾(K2Cr2O7)是一种主要的的无机试剂。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O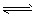 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
①若要使溶液的橙色加深,下列可采用的方法是。
| A.加入适量稀盐酸 | B.加入适量稀硫酸 | C.加入适量烧碱固体 | D.加水稀释。 |
(2)向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,此时溶液中c(Pb2+)/ c(Ba2+)=[结果保留一位小数;已知Ksp(BaCrO4)=1.2×10-10;Ksp(PbCrO4)=2.8×10-13]。
已知:2SO2(g)+O2(g) 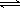 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。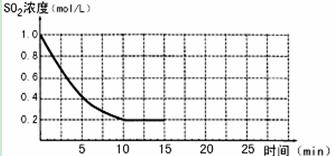
回答下列问题
(1)前10分钟内O2的平均反应速率为mol/(L·min)
(2)平衡时,02的转化率为,此时反应共放热kJ。
(3)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达到新平衡,此时c(O2)=1.15 mol/L,请在图上画出15-25分钟SO2的浓度变化曲线。
为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在(填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |