(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)K2SO4溶液呈_______(填“弱酸性”、“中性”或“弱碱性”),其理由是 (用离子方程式表示)。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(3)若25℃时,0.10 mol/L的NaHSO4溶液中c(SO42-)="0.03" mol/L,则HSO4-的电离常数Ka= (保留两位有效数字)。0.10 mol/L的H2SO4溶液中c(H+) 0.13mol/L (填“>”、“=”或“<”)。
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是:。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=_________。已知:K(300℃)>K(350℃),该反应是________热反应。
(2)下图中表示NO2的变化的曲线是______。用O2表示从0~2s内该反应的平均速率v=___________。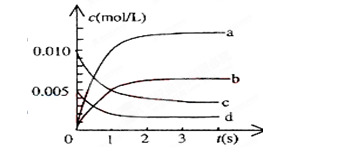
(3)能说明该反应已经达到平衡状态的是___________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。
③加入催化剂,平衡 移动。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式: _________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2  Fe + 2ZG
Fe + 2ZG 
放电时,电池的正极反应式为_____________:充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为___________________。
有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图(其中虚线框内为未知部分的结构)所示,A可发生如下转化(其中部分产物已略去)。
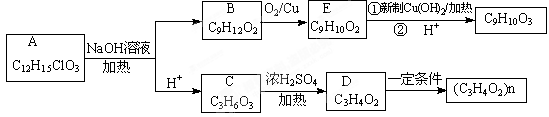
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1mol B最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。回答下列问题。
(1)写出C中官能团的名称_______________________。
(2)A的结构简式(写出一种):_________________________。
(3)写出反应类型:C→D________;B→E________。
(4)写出E与新制Cu(OH)2反应的化学方程式_____________________________________。
(5)E有多种同分异构体,满足下列条件的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①含有苯环且苯环上只有一个取代基;②分子结构中含有甲基;③能发生水解反应。