下列各组表述中,两个微粒属于同种元素原子的是( )
| A.3P能级有一个空轨道的基态原子和核外电子的排布为1S22S22p63S23P4的原子 |
| B.2P能级有一个未成对电子的基态原子和价电子排布为2S22p5的原子 |
| C.M层全充满而N层为4S2的原子和核外电子排布为1S22S22p63S23P63d64S2的原子 |
| D.最外层电子数是核外电子总数的1/5的原子和价电子排布为4S24p5 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是()
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1 NA
④CO(g)的燃烧热是283.0kJ /mol,则2CO2(g)
/mol,则2CO2(g) 2CO(g)+O2(g)△H=+2×283.0kJ/mol
2CO(g)+O2(g)△H=+2×283.0kJ/mol
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
| A.①④⑤⑦ | B.①④⑦ | C.①③④⑤⑥ | D.②③⑤⑥ |
下列有关物质分类或归纳的说法中,正确的一组是()
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质
④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化
⑥植物油、直馏汽油都可与溴水反应
| A.①③⑤ | B.②④⑥ | C.①③④ | D.②⑤⑥ |
化学与社会、生活密切相关,下列有关说法不正确的是()
| A.利用清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 |
| C.抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
| D.乙醇属于可再生能源 |
我国规定,所有销售的食品包装标签配料表上食品添加剂应使用规定的产品名称或种类名称,其中甜味剂、防腐剂、着色剂应注明。右图标签注明的添加剂中属于着色剂的是
①柠檬酸②山梨酸钾③甜味素
④菠萝香精⑤柠檬黄⑥日落黄
| A.①②⑤ | B.②⑤⑥ | C.⑤⑥ | D.③④ |
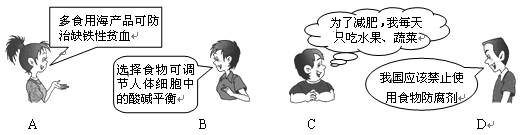
下面是4位同学对“化学与健康”这一话题发表的见解中,正确的是