X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)W2Y2含有的电子式为 。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因: 。
(2)N元素基态原子的外围电子排布式是: 。
(3)X3-的空间构型是 ,中心原子的杂化方式是 。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 。
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.0.1mol·L-1 NaHCO3溶液中:Na+、NH4+、SO42-、NO3- |
下列有关化学用语的表示不正确的是
A.NaClO的电子式: |
B.16O的原子结构示意图: 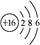 |
| C.质子数为53,中子数为72的碘原子:125 53I |
D.间羟基苯甲醛的结构简式: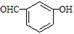 |
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能。下列关于石墨炔的说法不正确的是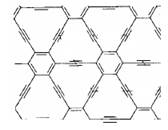
| A.石墨炔属于芳香烃 |
| B.石墨炔与金刚石互为同素异形体 |
| C.石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 |
| D.石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
构成A、B、C、D、E五种物质的元素中,只有一种不属于短周期元素。A、B、C、D、E五种物质之间的转化关系如图所示:
下列判断错误的是
A.若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4
B.若A和B都是盐,A难溶于水,而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为NaHSO4
C.若A是2∶1 型的离子化合物,B是硫酸盐,D既可溶于稀盐酸又可溶于NaOH溶液,且A与B的物质的量之比为3∶1时恰好完全反应,则B的化学式为Al2(SO4)3
D.若A是1∶1型的离子化合物,A与过量的B溶液反应才有D生成;将C燃烧的产物通过装有碱石灰的干燥管或盛有浓硫酸的洗气瓶,两者的质量都增加,则B的化学式一定为Al2(SO4)3
在给定条件下,下列画线物质在化学反应中能被完全消耗的是
| A.用浓盐酸与二氧化锰共热制氯气 |
| B.标准状况下,将1 g铝片投入20 mL 18 mol·L-1硫酸中 |
| C.向100 mL 4 mol·L-1硝酸中加入5.6 g 铁 |
| D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用氮气和氢气合成氨 |