BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。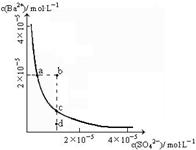
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由 。
②在25℃时,1L水中约能溶解0.0197g碳酸钡,且胃液是酸性的, (填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”,理由是
铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 |
钠 |
镁 |
铝 |
硅 |
| 电负性 |
0.9 |
1.2 |
χ |
1.8 |
①铝的电负性χ的范围是。
②电负性的数值与元素金属性的关系是。
③下列实验能比较镁和铝的金属性强弱的是。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s)ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s)ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”)极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是。
紫外线吸收剂广泛用作有机高分子材料的抗老化剂及化妆品中的防晒剂,其系列产品有许多种类,其中第Ⅰ类产品为二苯甲酮( )及其衍生物,第Ⅱ类为苯甲酸苯酯(
)及其衍生物,第Ⅱ类为苯甲酸苯酯( )的衍生物,某紫外线吸收剂UV-0(属于第Ⅰ类产品)的合成路线如下:
)的衍生物,某紫外线吸收剂UV-0(属于第Ⅰ类产品)的合成路线如下:
已知:

请回答:
(1)A 的结构简式为,③的反应类型为 ;
(2)反应②的化学方程式为;
(3)产物UV-0的同分异构体中,符合第Ⅱ类产品结构的有机化合物共有种;
(4)BAD也是一种紫外线吸收剂,属于第Ⅱ类产品,它的结构简式如下:
BAD中的含氧官能团为(填名称),
1mol BAD最多能和含mol NaOH的溶液进行反应;
(5)BAD 2
2 + M
+ M
M的核磁共振氢谱表明共含有种不同环境的氢;写出含有同样种类的氢且比例关系相同的其中一种同分异构体的结构简式。
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 =" –" 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 =" –" 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 =" –" 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则Tl ________T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =___________
(3)某实验小组利用CO(g) 、 O2(g) 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为___________。
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 性质信息 |
能形成+7价的化合物 |
日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_________,将A 溶于水,其水溶液中离子浓度由大到小的顺序是_______________ 。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式__________ 。
酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是________ →_________。
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛。该反应的化学方程式为_________。
(3)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是_______(填写化学式)。