化合物D是硅橡胶的稳定剂,其合成路线如下图
(1)B的分子式为 ; C中官能团名称 。
(2)C→D的反应类型为 。
(3)B→C的化学方程式为 。
(4)化合物D可能具有的性质有 (选填序号)。
a.与FeCl3溶液发生显色反应 b.加成反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备 ,反应类型依次是 (选填序号)。
,反应类型依次是 (选填序号)。
a.加成、 取代、 消去 b.消去、加成、取代 c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式 。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
在A、B、C、D、E五种短周期元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
(1)画出D的原子结构示意图:,五种元素原子半径从大到小的顺序是(填元素符号);
(2)A与B形成的化合物中,含非极性键的化合物的结构式为;
(3)C与B按原子个数比为1:1形成化合物的电子式是;
(4)D、E所形成氢化物的稳定性由强到弱的顺序是(填具体的化学式);
(5)由短周期元素组成的某些微粒,如SO2、O3、NO2-,可互称为等电子体,则与B、D同周期的元素组成的微粒中,能与N3-互称为等电子体的微粒是(填符合要求所有微粒的名称);
(6)写出工业上制E单质的化学方程式:。
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4:1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2:1反应形成盐丙。
(1)甲的电子式是。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是。
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于晶体,俗名叫;
(2)R的氢化物分子的空间构型是,属于分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是;
(3)X的常见氢化物的空间构型是,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是;
(4)Q分别与Y、Z形成的共价化合物的化学式是和,Q与Y形成的分子的电子式是,属于分子(填“极性”或“非极性”)。
为了维护社会秩序,保障公共安全,确保第26届世界大学生运动会的顺利进行,深圳市人民政府决定对257种化学品实施管制。氮化钠(Na3N)就是其中一种,它是科学家制备的一种重要的化合物,与水作用可产生NH3。
请根据材料完成下列问题:
(1)Na3N的电子式是,该化合物由键形成。
(2)Na3N与盐酸反应生成种盐,其电子式分别为。
(3)Na3N与水的反应属于反应。(填基本反应类型)
(4)比较Na3N中两种粒子的半径:r(Na+)r(N3-)(填“>”“=”或“<”)。
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示: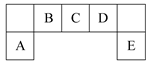
(1)B、C、D元素电负性的大小顺序为:>>(填元素符号)。
(2)E的氢化物与其最高价氧化物对应的水化物的钾盐共热能发生反应生成一种气体单质,反应的化学方程式为。
(3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是。
(4)在298 K下,A、B的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3 mol B的单质,则该反应在298 K下的ΔH=。(注:题中所设单质均为最稳定单质)
(5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是。
(6)用A、B的单质作电极,C的最高价氧化物对应水化物的浓溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式。(假设C只被还原至+4价)