已知反应:CO (g) + H2O(g) CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/ 3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号)
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比 较,则下列说法中正确的是 (填序号)
较,则下列说法中正确的是 (填序号)
①生成物的产量一定增加  ②反应物的浓度一定降低
②反应物的浓度一定降低
③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低
【化学—化学与技术】硫酸是一种重要的化工原料,硫酸工业的“三废”处理之一是对尾气处理,其中一种方法便是用天然海水进行尾气脱硫。
(1)硫酸工业生产的主要设备有、和吸收塔。在吸收塔内装有大量磁环的作用是,浓硫酸从塔顶喷下,SO3吸收操作采取形式(原理);硫酸工业的尾气主要成分有SO2、O2、N2等。
(2)天然海水主要含有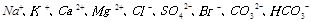 等离子。
等离子。
①天然海水pH约为8,原因是海水中离子水解所致。
②尾气进入吸收塔内,塔顶喷下大量海水,O2能将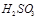 、
、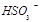 、
、 等氧化,试写出其中一个反应的方程式:。
等氧化,试写出其中一个反应的方程式:。
③向氧化后的海水中加入天然海水,其目的是中和、稀释氧化后海水中生成的酸,最终排放出的海水中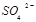 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,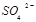 浓度(填序号)。
浓度(填序号)。
| A.减少 | B.增大 | C.不变 | D.无法判断 |
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取: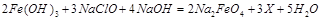 ,则X的化学式为。
,则X的化学式为。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为。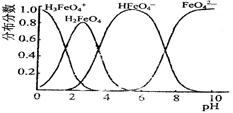
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为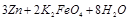

 则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。
则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下: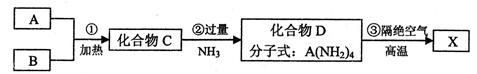
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。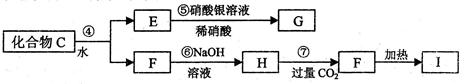
按要求回答下列问题:
(1)C的化学式为;X的化学式为 。
。
(2)写出下列方程式
反应②的化学方程式 ;
;
反应⑦的离子方程式。
合成氨反应(
 2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题: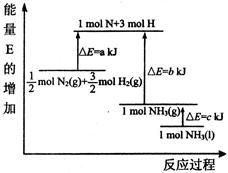
(1)合成氨反应的能量变化如图所示,则该反应的热化学方式为(△H用图给字母表示)。
(2)在温度恒定为298K,体积恒定为10L的密闭容器中测得合成氨反应达到平衡时氢气、氮气、氨气的物质的量分别为0.1mol、0.4mol、4mol,则此温度下题给该反应的平衡常数K=
(3)标况下,若将22.4mL的氨气通入100mLpH为2的盐酸中,则溶液中各离子浓度的顺序由大到小为。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入足量的CO2,过滤后即可得到(NH4)2SO4。该过程的化学方程式为,由此可知Ksp(CaSO4)Ksp(CaCO3)(填“大于”、“小于”或“等于”)
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。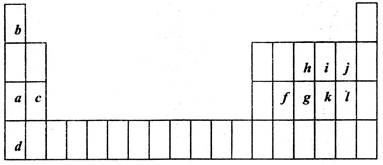
请你根据表中所给元素,回答下列问题:
(1)在短周期的所有元素中的原子半径与的原子半径之比最小(不包括稀有气体)(填元素符号)。
(2)金属性最强的元素与氧气反应生成化合物的化学式是(填两种即可),j和k氢化物比较,稳定性强的是(填写氢化物化学式)。
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质做消毒杀菌剂的原因是(用化学方程式表示)
(4)常温下某液态化合物只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性。