⑴下列物质属于非电解质的是 ,属于弱电解质的是 (填序号)。
①氨水 ②SO2 ③CI2 ④次氯酸 ⑤BaSO4 ⑥乙醇 ⑦H2O ⑧NaHCO3
⑵用浓度为0.1 mol·L-1标准盐酸滴定氢氧化钠溶液时,以下操作会使结果偏低的是
(填序号)。
①锥形瓶用待测液润洗 ②酸式滴定管读数是滴前仰视滴后俯视
③配制氢氧化钠溶液时混有碳酸钠 ④酸式滴定管未用标准液润洗
(3) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式: ;此时溶液呈 性(填“酸性”,“中性”或“碱性”),原因: 。
[化学——选修3:物质结构与性质](15分)硼(B)及其化合物在化学中有重要的地位。请回答下列问题:
(1)Ga与B同主族,Ga的基态原子核外电子排布式为,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序是。
(2)硼酸(H3B03)是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
①硼酸中B原子的杂化轨道类型为。
②硼酸晶体中存在的作用力有范德华力和。
③加热时,硼酸的溶解度增大,主要原因是。
④硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的OHˉ而呈酸性。写出硼酸的电离方程式_。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,在热水中水解生成硼酸钠和氢气,用化学方程式表示其反应原理。[BH4]-的空问构型是____。
(4)B3N3H6可用来制造具有耐油、耐高温性能的特殊材料。写出它的一种等电子体物质的分子式。
(5)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为 。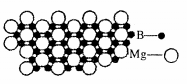
(6)金刚石的晶胞如图。立方氮化硼的结构与金刚石相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是____g·cmˉ3(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
(1)操作a的名称,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为。
(4)水泥常用做建筑材料,是利用了水泥的性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“="”" )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液d、KMn04溶液、稀硫酸
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K=(用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:COH2(填“>” 、“<” 或“="”" )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是。(填写相应字母)
| A.使用高效催化剂 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.不断将CH30H从反应混合物中分离出来 |
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
写出开始电解时阳极的电极反应式 。
(14分)SO2 、CO 、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 =" -" 197 kJ•mol-1
2SO3(g) △H1 =" -" 197 kJ•mol-1
H2O(g) = H2O(l)△H2 =" -" 44 kJ•mol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 =" -" 545 kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据则x=______kJ•mol-1。
| 化学键 |
H-H |
O═O |
O-H |
| 断开1mol化学键所需的能量/kJ |
436 |
x |
463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJ•mol-1
CH3OH(g) △H=-90 kJ•mol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO (g)和2 mol H2(g) |
1 mol CH3OH(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出54kJ |
吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,则:
A点的平衡常数KA=,
B点的平衡常数KBKA。(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是(至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
则a电极名称为_______,
b电极反应式为_________________。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为,操作1为。
(2)加入H2O2的作用是(用离子方程式表示),加入氨水的作用是。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为。