X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 。
(2)ZW2的电子式是 。
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是 。
选考【化学-物质结构与性质】尿素是目前含氮量最高的氮肥,作为一种中性肥料,尿素适用于各种土壤和植物。它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥。已知尿素的结构式为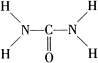 。另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。请回答下列问题:
。另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。请回答下列问题:
(1)基态Fe3+的核外电子排布式为 ;C、N、O三种元素的电负性由大到小的顺序是 。
(2)尿素分子中N原子的杂化方式是 。三硝酸六尿素合铁(Ⅲ)中的NO3—空间构型是________。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____。Fe(CO)在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g),已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有_____。
Fe(s)+xCO(g),已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有_____。
(4)铁的金属密堆积方式为体心立方结构,结构如图所示。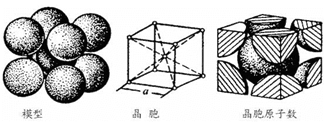
则晶胞中铁原子的配位数为__________。如果铁原子的半径为r pm,则该堆积方式的空间利用率的计算式为_______________。(不必计算结果)
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
已知:①Fe3+ 、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要的主要玻璃仪器有______________。
(2)氧化步骤中发生的离子反应方程式有____________________________________
和H3AsO4+Fe3+=FeAsO4↓+3H+。
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol/L。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I的程序依次为 、 、过滤、干燥。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式 。
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g)ΔH2=-283 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g)ΔH3=-242 kJ·mol-1
则反应①的ΔH=________。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。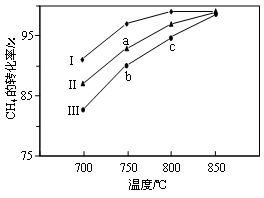
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)CO和氢气在一定条件下可以合成甲醇,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
③在某温度和压强下,将一定量 CO与H2充入密闭容器发生上述反应,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c(H2)减少; B.平衡常数K增大; C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢; E.重新平衡c(H2)/c(CH3OH)减小
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g)△H=Q1kJ·mol-1
CH3OH(l)+H2O (g)△H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l)△H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用⑴中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g)△H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g)△H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是。
a.升高温度b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
①a物质是,A电极的电极反应式为。
②乙装置中的总化学反应方程式为。
③当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH=。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
|
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。