三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 |
A |
B |
C |
| 结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+ 2两种常见化合价 2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键 (任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 ;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。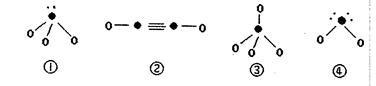
在以上分子中,中心原子采用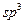 杂化形成化学键是 (填写序号);在②的分子中有 个
杂化形成化学键是 (填写序号);在②的分子中有 个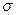 键和 个
键和 个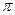 键。
键。
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)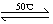 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
(2)Ni(CO)4(g) 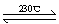 Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为 。
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
a.平衡常数K增大b.CO的浓度减小
c.Ni的质量减小d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g)△H=+85.1kJ·mol-1
B(g)+C(g)△H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h |
0 |
4 |
8 |
16 |
| C(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。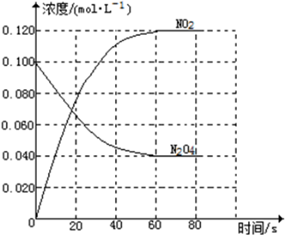
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
反应A(g)  B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1)△H1= -19.5kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2 H2O(g)△H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。