反应A(g)  B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:

(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
化学电池在通讯、交通及日常生活中有着广泛的应用。
⑴下列相关说法正确的是
A.通过某种电池单位质量或单位体积所能输出能量的多少 ,可以判断该电池的优劣
,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、甲烷、乙烷、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
⑵目前常用的镍(Ni)镉(Cd) 电池,其电池总反应可表示为:
电池,其电池总反应可表示为:
2Ni(OH)2+Cd(OH)2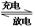 Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,下列说法正确的是:
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
⑶在宇宙飞船和其它航天器上经常使用的氢氧燃料电池是一种新型电池,其结构如图所示:a、b两个电极均由多孔的炭块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
①a电极是电源的 极
极
②若该电池为飞行员提供了36Kg的水,则电路中通过了mol电子。
海水是人类资源的宝库, “海水晒盐”是获取食盐的重要来源。食盐既是一种生活必需品,也是一种重要的工业原料。以食盐为原料可以得到多种产品。
⑴工业上用NaCl制备金属钠的化学方程式是。
⑵工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。
①该过程中阴极的产物是 ;阴极反应为:
;阴极反应为:
②阳极反应式为,检验该电极反应产物的方法是:
。
③当阴极上收集到标准状况下气体22.4L时(假设产生的气体完全被收集),则电路中通过电子的数目为NA。
⑶电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,请写出相应的化学方程式:
(用一个方程 式表示)。
式表示)。
⑷海水电解制得的氢气用于合成氨,某合成氨厂生产流程如下: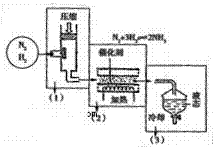
①在第(1)个设备中先把N2 、H2压缩的目的是 :
: 。
。
②在第(3)个设备中用冷却的方法分离出其目的是:
。
Ⅰ、北京时间11月1日清晨5时58分07秒,中国“ 长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ·mol-1
C(S)+O2(g)=CO2(g);ΔH=–393.5kJ·mol-1[来
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量 的H2、C、CH
的H2、C、CH 4完全燃烧时放出热量最多的是。
4完全燃烧时放出热量最多的是。
⑵根据以上反应,则C(S)+2H2(g)=CH4(g)的焓变ΔH=。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
。
Ⅱ、据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解 金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是。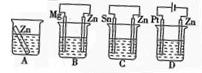
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。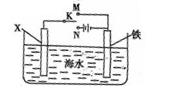
已知A是我们家庭中常见的一种调味剂,其焰色反应呈黄色; E是引起温室效应的主要气体之一;反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化 合物E的反应。根据下列反应框图填空:
合物E的反应。根据下列反应框图填空: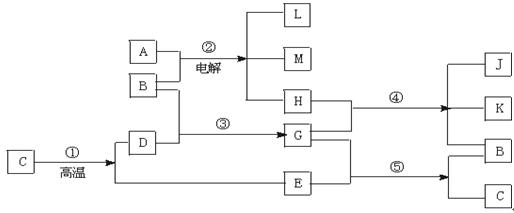
(1)写出有关物质的名称或化学式:
B,C,H。
(2)写出②发生反应的化学反应方程式
。
写出④发生反应的化学方程式,并用双线桥表示出电子转移的方向和数目 。
 现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:
现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:
(1)将一定量的固体溶于水,得到无色澄清的溶液;
(2)将实验(1)中的溶液分成三份:在第一份溶液中加入足量的氢氧化钠溶液并加热,生成一种能使湿润红色石蕊试纸变蓝色的气体;在第二份溶液中滴入足量的稀盐酸,生成一种能使澄清石灰水变浑浊的气体;在第三份溶液中加入新制的氯水后,溶液变成深黄色,加入四氯化碳后振荡、静置,下层液体呈紫 红色。试
红色。试 回答下列问题:
回答下列问题:
(1)原固体混合物中一定存在的物质是,一定不存在的物质是 。
(2)实验(2)中第一份溶液与氢氧化钠溶液共热时发生的反应方程式
。