在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h |
0 |
4 |
8 |
16 |
| C(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
(化学一有机化学基础,1 3分)几种解热镇痛药的结构如下: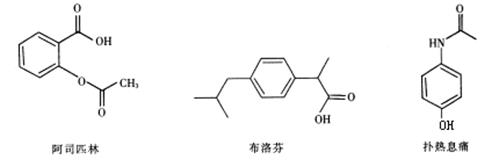
(1)阿司匹林和布洛芬含有的酸性官能团为_____________________(填名称)。
(2)1mol阿司匹林分别与足量NaOH溶液、NaHCO3溶液反应,消耗溶质的物质的量之比为________。
(3)扑热息痛与足量NaOH溶液反应的化学方程式为_________________________。
(4)某医药中间体的合成如下: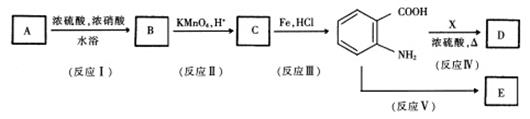
①反应II的反应类型为___________________。
②若B与扑热息痛互为同分异构体,则A的结构简式为_______________________.
③若X的分子式为C3H6O2,且D能发生银镜反应,则D的结构简式可能为______________。
④若E为热固性很好的功能高分子,则反应V的化学方程式为________________。
(化学一物质结构与性质,13分)铜及其化合物在现代生活中应用广泛。
(1)用黄铜矿炼铜的最后一步反应为:
①硫元素的基态原子核外电子排布式为__________________。
②铜元素的电离能: ___________
___________ (填“>"或“<")。
(填“>"或“<")。
③反应中形成的化学键类型为_________________。
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图。
已知A为第二周期元素。
①配合物M的晶体类型为________________。
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是_______________(填元素符号)。
③1 mo1有机物X中含 键的数目为________________。
键的数目为________________。
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是________________________。
[化学-物质结构与性质]碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:
(1)已知碳、氧、氯三种元素可形成CCl4、ClO:等物质,则C,O、Cl的电负性从大到小的顺序为______。
(2)基态铜原子的核外电子排布式为___________________________。
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为_________。
(4)lmolCH3COOH分子中含有ɑ键数目为___________。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
①维生素B1中碳原子的杂化轨道类型有__________________
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________________。
| A.离子键、共价键 | B.离子键、氢键、共价键 |
| C.氢键、范德华力 | D.离子键、氢键、范德华力 |
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3,的溶解度却小于Na2C03,这是由于____________。
(15分)
I.已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的原子结构示意图为________________。
(2)若甲是10电子的阳离子,乙是碱性气体。lmol乙通人足量强酸溶液中与H+反应,反应过程中能量变化如图,该反应的热化学方程式是__________________________。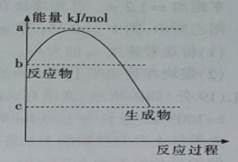
(3)若甲仅含有N03-、SO42-和X三种离子(不考虑水电离的H+、OH-),则X离子可能是_____________(填序号)。
| A.Fe2+ | B.HC03- | C.Ba2+ | D.Fe3+ |
(4)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=a,则HCO3-的电离平衡常数Ka=___.
Ⅱ.在恒容密闭容器中通入X并发生反应:  ,温度
,温度
下X的物质的量浓度c(X)随时间t变化的曲线如图所示。
(5)温度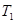 ___________
___________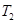 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(6)M点的正反应速率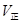 __________N点的逆反应速率
__________N点的逆反应速率 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(7)该反应进行到M点放出的热量与进行到W点放出的热量相比:_____________(填“更多”、“更少”或“相同”)
选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。