X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
| A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 |
B.元素X不能与元素Y形成化合物 |
C.元素Y、R分别与元素X形成的化合物的热稳定性: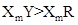 |
| D.元素W、R的最高价氧化物的水化物都是强酸 |
下列说法中正确的是( )
| A.25℃时,NH4Cl和NH3 .H2O的混合液中离子浓度可能为C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| B.向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 |
| C.25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 |
| D.25℃时,向稀氨水中通入NH3,溶液中C(OH-)减小 |
下列仪器中没有零刻度的是()
| A.温度计 | B.量筒 | C.滴定管 | D.托盘天平游码标尺 |
在硫化钠溶液中存在的下列关系不正确的是()
| A.C(Na+)=2C(S2-)+2C(HS-)+2C(H2S) | B.C(Na+)+C(H+)=C(OH-)+C(HS-)+C(S2-) |
| C.C(OH-)=C(H+)+C(HS-)+2(H2S) | D.C(Na+)>C(S2-)>C(OH-)>C(HS-) |
相同条件下,①氯化钠溶液 ②醋酸钠溶液③碳酸钠溶液 ④碳酸氢钠溶液,它们的PH相对大小为()
| A.④>③>②>① | B.③>④>②>① | C.②>③>④>① | D.③>②>④>① |
用蒸馏水湿润过的pH试纸测得某氨水溶液的pH等于8,则该氨水溶液的pH可能是()
| A.9 | B.8 | C.7 | D.6 |