实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。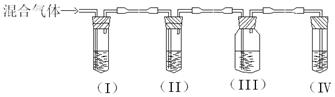
I、II、III、IV装置可盛放的试剂是:I: II: III:
IV: (请将下列有关试剂的序号填入空格内)
| A.品红 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是 ;
使用装置II的目的是 ;
使用装置III的目的是 ;
确定含有乙烯的现象是 。
.某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和(填字母)。
(2)写出步骤④中发生反应的离子方程式。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+ + ClO3— += Fe3++ Cl— + H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成(填偏大、偏小或不影响),
(4)若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为。(列出算式,不需化简)
有一瓶澄清溶液, 可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO 、CO
、CO 、NO
、NO 、
、
Cl-、I-现进行如下实验:
(1)测知溶液显强酸性;
(2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;
(5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。
问:①原溶液中肯定存在的离子是;
②肯定不存在的离子是;
③不能确定是否存在的离子是。
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
(1)该注射液中葡萄糖的物质的量浓度 ___________________。
(2)配制上述l L溶液所需的仪器有:量筒、烧杯、玻璃
棒、托盘天平、药匙、_____________、______________。(在横线上填写所缺仪器的名称)(3)在1L此溶液的配制过程中,下列操作或说法正确 的是_________________。
| A.配制过程中加水时不慎超过了刻度线,把水吸出后再加水刚好至刻度线 |
| B.用托盘天平可以准确称量计算所得葡萄糖的质量 |
| C.用胶头滴管加水时,仰视观察凹液面与容量瓶刻度线相切会导致结果偏低 |
| D.容量瓶使用前未干燥,不会影响实验结果 |
取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应。甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末。
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为(以上用“甲、乙”和 “>、 < 、 ="”" 回答)
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌。回答以下问题。
①三支试管中参加反应的锌的质量大小关系为:
(用“甲、乙、丙”和 “>、 < 、 ="”" 回答)
②反应终了,所需时间为: (同①)
③若以上三组实验,锌粉均过量,产生的氢气体积(同①)
中和滴定实验:
⑴ 取体积相同(25mL)的两份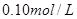
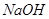 溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为
溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为 ,中和另一份溶液消耗盐酸的体积为
,中和另一份溶液消耗盐酸的体积为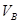 ,则①以甲基橙为指示剂
,则①以甲基橙为指示剂 和
和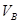 的关系是。②以酚酞为指示剂时,
的关系是。②以酚酞为指示剂时, 和
和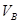 的关系是。
的关系是。
⑵ 某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作
| A.在250mL的容量瓶中定容配成250mL烧碱溶液 |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
| D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面, |
记下开始读数为V1
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
①正确操作步骤的顺序是(用字母填写)→→→ D →。
②滴定前或滴定后读数时应注意。
③E中在锥形瓶下垫一张白纸的作用是。
④D步骤中液面应调节到,尖嘴部分应。
⑤滴定终点时颜色变化是。
⑥若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会使测定结果
(指烧碱的纯度)(指偏高、低或不变)
⑦该烧碱样品纯度的计算式为。