“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是
________________________________________________________________________。
(2)如何检验铁片已经洗净
________________________________________________________________________
________________________________________________________________________。
(3)该小组的实验数据记录及数据处理如下,完成下列表格。(锌的密度为7.14 g/cm3)
| |
数据记录 |
数据处理 |
||||
| 镀锌铁皮 |
长度/cm |
宽度/cm |
镀锌铁皮质量/g |
铁皮质量/g |
锌镀层厚度(单侧)/cm |
锌镀层平均厚度(单侧)/cm |
| A |
5.00 |
4.90 |
4.460 |
4.313 |
4.201×10-4 |
|
| B |
5.10 |
5.00 |
4.421 |
4.267 |
4.229×10-4 |
|
| C |
5.20 |
5.00 |
4.640 |
4.467 |
4.660×10-4 |
计算镀锌铁皮锌镀层平均厚度(单侧)________cm。本实验中产生误差的地方可能有哪些(任意列举两
种)________________________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中。回答下列问题。
(4)装置中导管a的作用是
________________________________________________________________________
________________________________________________________________________。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是
____________________________________________________(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件下的气体摩尔体积为Vm L·mol-1)。则镀锌铁皮的厚度为
________________________________________________________cm。(写出数学表达式)
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
①;
②;
③;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称:。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是
I ;II ;III ;
IV(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是。
(3)使用装置II的目的是。
(4)使用装置III的目的是。
(5)确定含有乙烯的现象是。
(满分12分)用中和滴定法测定某烧碱样品的纯度。
⑴配制待测液: 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有___________________________________________。
⑵滴定: ①盛装0.20mol/L盐酸标准液应该用_______滴定管。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视________,滴定终点时,锥形瓶中的溶液的颜色变化是__________。
③有关数据记录如下:
| 滴定序号 |
待测液体积 (mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.70 |
| 2 |
20.00 |
6.00 |
26.00 |
⑶纯度计算:NaOH溶液的浓度为____________mol/L,烧碱样品的纯度为_________。
⑷对几种假定情况的讨论(填无影响、偏高、偏低)
①若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
②读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
实验室可以通过加热酒精和浓硫酸制备乙烯。但是产生的乙烯中有二氧化硫.而乙烯和二氧化硫都能使酸性高锰酸钾和溴水褪色。
完成下列化学方程式
A.二氧化硫使溴水褪色:
B.乙烯使溴水褪色:
(2)有人设计以下方案证明实验中产生的气体中既有二氧化硫又有乙烯如图所示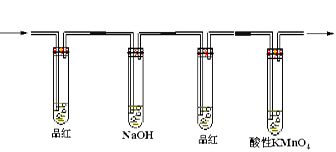
A B C D
回答以下问题
①能够说明有二氧化硫气体的现象
②使用装置的目
③使用装置的目的
④证明含有乙烯的现象
(共12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。实验室可以用装置F制备氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
请回答下列问题:
(1)、装置F中发生反应的离子方程式为_______________________________________;
(2)、为了快速制备氨气,装置A的烧瓶中可装试剂_____________________;
(3)、B装置的名称是_____________;(填符号) A.洗气瓶 B.干燥管 C.分液漏斗
E装置的作用是__________________________________________________________;
(4)通入C装置的两根导管左边较长、右边较短,目的是________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:_________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。