有关实验的叙述,正确的是( )
| A.用待测液润洗滴定用的锥形瓶 |
| B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
| D.读取滴定管内液体的体积,俯视读数导致读数偏小 |
下列各离子化合物中,阳离子与阴离子的半径之比最小的是( )
| A.KCl | B.NaBr | C.LiI | D.KF |
下列对应微粒的电子式书写正确的是( )
A.钾离子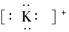 |
B.氦原子He∶ |
| C.氯离子Cl- | D.锂原子·Li∶ |
下列原子序数所对应的元素组中,两者可形成离子键的是( )
| A.1和17 | B.12和9 |
| C.14和6 | D.15和8 |
下列说法正确的是( )
| A.元素周期表中,族序数都等于该元素原子的最外层电子数 |
| B.每一周期元素都从碱金属开始,最后以稀有气体结束 |
| C.第二、三周期上下相邻元素的原子核外电子数相差8个 |
| D.同周期元素原子的最外层电子数相同 |
下表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
c |
d |
|||||
| 3 |
a |
b |
e |
f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强