将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )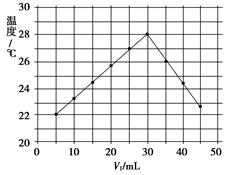
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可能转化为热能 |
| C.NaOH溶液的浓度约为1.0 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
1.NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,11.2 L氯气所含原子数目为NA |
B.2 L 0.2 mol / L K2SO4溶液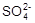 物质的量浓度为0.4 mol / L 物质的量浓度为0.4 mol / L |
| C.1 mol Na作还原剂可提供电子数为2NA |
| D.同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
22.根据下表提供的数据判断下列说法不正确的是
| 化学式 |
电离常数(25℃) |
| HCN |
K=5.0×10-10 |
| H2CO3 |
K1=4.3×10-7 |
| K2=5.6×10-11 |
A.等浓度等体积的NaCN、NaHCO3溶液混合:c(Na+)+c(H+)=c(HCO3-)+c(CN-)+c(OH-)+ 2c(CO32-)
B.若NaCN的水解平衡常数为: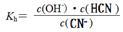 ,则25℃下:Kh≈2.0×10-5
,则25℃下:Kh≈2.0×10-5
C.等浓度等体积的NaCN和NaCl溶液中离子数目前者大于后者
D.过量CO2通入NaCN溶液中:CO2+H2O+CN-= HCO3-+ HCN
21.化学中通常用图像直观地描述化学反应进程或结果。下列图像及描述正确的是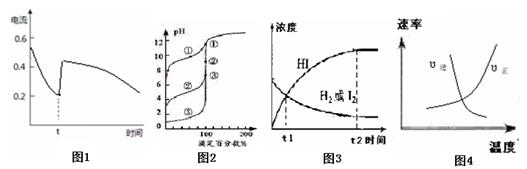
| A.图1表示Zn-Cu原电池反应过程中的电流强度的变化,t时可能加入了双氧水 |
| B.图2表示用0.1000mol·L-1NaOH溶液滴定浓度相同的三种一元酸,曲线①的酸性最强 |
C.图3表示可逆反应:H2(g)+I2(g)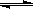 2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆 2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆 |
D.图4表示可逆反应:N2(g)+O2(g)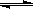 2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图 2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图 |
20.下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是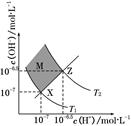
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.XZ线上任意点均有pH=7 |
| C.图中T1<T2 |
| D.M区域内任意点均有c(H+)<c(OH-) |
19.下列说法正确的是
| A.在“研究反应速率的影响因素”实验中:Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O,可通过观察产生气泡的快慢来比较不同条件下该反应的速率大小 |
| B.为了精确测定盐酸与氢氧化钠溶液反应的反应热,当两者混合后,立即读取温度计的读数,防止热量散失 |
| C.将铁粉、碳粉、少量氯化钠和水混合放在塑料袋中搓揉,用手触摸会感觉到发热,袋里产生大量铁锈 |
| D.酸碱中和滴定实验中,终点判断过迟,导致标准液滴多,只能重新滴定 |