下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是 ( )
| A.电池放电时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移的电子为3mol |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O |
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是 ( )
A.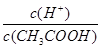 |
B. |
C.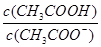 |
D. |
用铂(惰性)电极进行电解,下列说法中正确的是()
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
常温下,下列各组离子在溶液中一定能大量共存的是()
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl—、SO42— |
| B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3— |
| C.由水电离产生的c(H+)=10—13mol/L的溶液:NH4+、Ba2+、AlO2—、Cl— |
| D.pH=12的溶液:K+、Na+、CH3COO-、Br— |