为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活泼性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜、锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是______________________________。甲同学的设计思路是________________________________________________________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是________________________________________________________________________,
________________________。乙同学判断出锌、铜金属活动性相对强弱所依据的原理是________________________________________________________________________
________________________________________________________________________,
________________________________________________________________________。
(3)丙同学使用直流电源和石墨电极组装电解装置,向乙同学实验后的溶液中补充了必要的试剂(作电解液)。反
应在调控下开始,有关电化学反应的化学方程式为______________________________。获得的明显实验现象是
________________________________________________________________________
________________________________________________________________________。
(4)请你再单独设计一个简单实验(试剂、仪器自选),证实锌和铜金属活泼性的相对强弱(简要说明操作步骤及现象)____________________________________
________________________________________________________________________
________________________________________________________________________。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)
氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H =KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,身被还原为四价钒化合物;四价钒化合物
再被氧气氧化。写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1、υ(SO3)=mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的△H = 。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: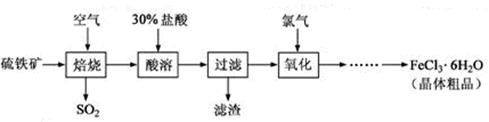
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。 (2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学式)。
I. 恒温、恒压下,在一个容积可变的容器中发生如下反应: A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a mol C,这时A的物质的量
为_____mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol。
(3)若开始时放入x mol A、2molB和l mol C,到达平衡后,A和C的物质的量分别
是y mol和3a mol,则x ="_____mol," y =_____mol。平衡时,B的物质的量_____(选
填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
________。
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入l mol A和l mol B到达平衡后生成b mol C。将b与(1)小题中的a进
行比较________________ (选填一个编号)。
(甲)a < b (乙) a > b (丙) a =" b" (丁) 不能比较a和b的大小。
将固体NH4I置于密闭容器中,某温度下发生下列变化:
NH4I(s) 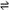 NH3 (g) + HI(g) 2HI(g)
NH3 (g) + HI(g) 2HI(g) 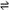 H2(g) + I2(g)
H2(g) + I2(g)
当反应达到平衡时c (H2)=" 0.5" mol/L, c (HI)=" 4" mol/L, 则 c(NH3),HI 的
分解率为。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的
关系是。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____
方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___态。