已知硫代硫酸钠溶液与稀H2SO4反应可析出单质硫沉淀:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,某同学按下表进行实验,请你判断哪一组先出现浑浊?
| 编号 |
加3% Na2S2O3(mL) |
加1∶5的H2SO4(滴) |
温度(℃) |
出现浑浊的快慢 |
| 1 |
5 |
25 |
室温 |
|
| 2 |
5 |
15 |
室温+10 |
|
| 3 |
5 |
25 |
室温+20 |
|
答案:________________。
我国农业因遭受酸雨而造成每年高达15亿多元的损失。为有效地控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》。
回答下列问题:
(1)你认为减少酸雨的产生可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(2)在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2的浓度。在20世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2的浓度降低了30%。请你从全球环境保护的角度,分析这种方法是否可取。简述其理由。
1995年诺贝尔化学奖授予致力于研究臭氢层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外线,保护地球上的生物。氟里昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:O3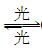 O2+O Cl+O3―→ClO+O2ClO+O―→Cl+O2 总反应:2O3―→3O2
O2+O Cl+O3―→ClO+O2ClO+O―→Cl+O2 总反应:2O3―→3O2
(1)在上述臭氧变成氧气的反应过程中,Cl是( )
A.反应物 B.生成物C.中间产物 D.催化剂
(2)O3和O2是( )
A.同分异构体 B.同系物
C. 氧的同素异形体 D.氧的同位素
某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
淀粉溶液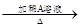 混合物
混合物
混合物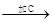 红色沉淀D
红色沉淀D
(1)各步加入的试剂为:
A________,B__________,C__________。
(2)加入A溶液而不加入B溶液是否可以________(填“可以”或“不可以”),其理由是_____________________________________________________________。
(3)若析出1.44 g红色沉淀,淀粉的水解率是__________。
甲、乙两位学生分别做淀粉水解产物检验的实验,操作如下:学生甲在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液,加热10 min后,再将溶液一分为二,其中一份溶液做银镜反应实验,结果无银镜出现,另一份溶液加入碘水,结果无蓝色出现;学生乙在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液少许,加热45 min后,加入过量的NaOH溶液中和硫酸,再将溶液一分为二,其中一份溶液做银镜反应实验,结果有银镜产生,另一份溶液中加入少量碘水,未出现蓝色。试回答:
(1)学生甲的实验操作不正确的地方是_____________________________________。
根据甲的实验现象,淀粉的水解情况是________。
A.完全水解 B.部分水解C.没有水解 D.不能准确判断
(2)学生乙的实验操作不正确的地方是_____________________________________。
根据乙的实验现象,淀粉的水解情况是________。
A.完全水解 B.部分水解C.没有水解 D.不能准确判断
森林是国民经济的宝贵资源,它不仅提供木材和多种林副产品,而且在保护环境、维持生态平衡方面起着极为重要的作用,试回答:
(1)森林通过什么途径吸收CO2,防止温室效应?
__________________________________________________________。
(2)木材是重要的化工原料,其主要成分是纤维素,纤维素分子由很多个________单元构成,在每个单元中含有________个羟基,所以纤维素能发生____________反应,它与浓H2SO4和浓HNO3的混合物发生反应的化学方程式是______________。
(3)纤维素在浓硫酸的作用下水解的最终产物是______________________________
(填结构简式)。写出在医学上检验该物质的化学方程式__________________________。