(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据:
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
(3)常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液,消耗盐酸的体积分别为V1、V2,则V1_____V2(填“>”“<”或“=”下同);
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
写出下列物质电离或盐水解的离子方程式:
(1)NaHSO4溶于水_______________________________________________________
(2) H2S的电离________________________________________________________
(3)氯化铁溶液:;
(4)碳酸钠溶液:;
(5)AlCl3与NaHCO3混合____________________________________________________
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末
(1)废旧印刷电路板中回收的铁是新型电池的使用材料,如制成LiFePO4电池,它可用于电动汽车。电池反应为:FePO4+Li  LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ·mol-1
则在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:。
(3)部分金属的回收需要氧化性很强的溶液,如金常用和的混合溶液溶解
(4)为了分离金属粉末常用到氰酸(HCN)溶液,HCN是一种有毒且较弱的酸,已知:常温下HCN的电离程度非常小,其Ka=6.2×10-10,0.1mol/L的NaCN的pH=11.1,0.1mol/L的NH4CN的pH=9.2,则浓度都是0.1mol/L的NaCN和NH4CN溶液中,CN-水解程度大小为:NaCNNH4CN(填:> = < ),理由是:
金属镍(Ni)的应用越来越广泛。
(1)LiNiO2常用作锂离子电池的正极材料,负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
xLi+Li1-xNiO2 LiNiO2
LiNiO2
LiNiO2中,Ni元素的化合价为;充电时,LiNiO2中化合价发生变化的元素有(填元素符号)
(2)Ni常被镀在金属制品上以保护金属不生锈。镀镍的方法有:
方法Ⅰ:电镀镍。以NiSO4为电镀液。
① 待镀零件与电源相连,金属镍板与电源相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)Ni2+ + H2PO2-+ →Ni + + H2PO3-+
(b)6H2PO2- + 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
② 请在答题卡上写出并配平反应式(a)。
③ 化学镀与电镀相比较,在原理上的相同点是:。 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应:
利用该反应可以提纯粗Ni,得到高纯度的金属Ni。
① 该反应的平衡常数表达式为
② 生产中,在如图所示密闭容器中充入CO气体,粗Ni放置在(填编号) A.低温区 B.高温区
A.低温区 B.高温区
丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:
回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式______________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有
 、、___________________________________。
、、___________________________________。
下面是某高分子有机物的合成路线,Ⅲ、V为Ⅵ的单体。
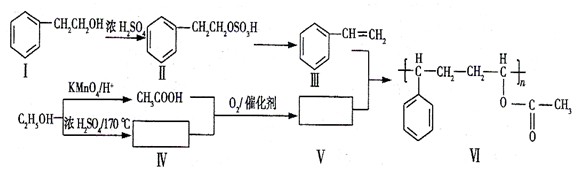
回答下列问题:
(1) 由Ⅱ生成Ⅲ的反应类型名称为。
(2)下列关于化合物I、Ⅱ和Ⅲ的说法中,正确的是(填字母)。
A.化合物I可以发生氧化反应B.化合物I不能与Na反应生成氢气
C.从I→Ⅱ和Ⅱ→Ⅲ两反应来看,I→Ⅲ过程中浓硫酸有催化剂的作用
D.化合物Ⅲ与HCl加成,只能生成一种有机产物
(3)化合物V是(填字母)类化合物。
A.醇 B.烷烃 C.烯烃 D.酸E.酯
(4)在上述合成路线中,化合物Ⅳ和CH3COOH在催化剂的作用下与氧气反应生成V和水,写出反应方程式。
(5)下图为分离化合物V、乙酸和乙醇混合物的实验操作流程图:
在上述实验过程中,所涉及的三次分离操作分别是。
A.①蒸馏②过滤③分液B.①分液②蒸馏③蒸馏
C.①蒸馏②分液③分液D.①分液②蒸馏③结晶、过滤
(6)写出I的同分异构体中能让FeCl3溶液显紫色的任意一种结构简式:
。
(7)写出反应III+V→VI的化学方程式:(不要求写反应条件)
。