2011年4月7日,甘肃省平凉市崆峒区发生一起疑似食物中毒事件,中毒病例均服用过散装牛奶,确认系亚硝酸盐中毒。造成3名婴幼儿死亡,39名中毒患者被送往当地医院救治,称为“4·7”牛奶中毒事件。请回答下列问题:
(1)工业用盐亚硝酸钠外观极像食盐,人若误食亚硝酸钠会中毒。亚硝酸钠中氮元素的化合价是________价。
A.+1 B.+2
C.+3 D.+4
(2)食品与健康相关,下列做法不会危害人体的是________。
A.香肠中加过量的亚硝酸钠
B.饲养猪加入瘦肉精
C.蒸馒头加适量纯碱
D.长期使用铝餐具
(3)区别亚硝酸钠与食盐的有效方法是隔绝空气加热,没有明显变化的是食盐,能分解放出刺激性气味气体的是亚硝酸钠,此气体可能是________。
A.SO2 B.NH3
C.N2 D.NO2
(4)已知NaNO2能发生如下反应(方程式已配平):2NO+xI-+yH+===2NO↑+I2+zH2O,则x的数值是________,根据是________________;y的数值是__________,根据是________。
(5)根据上述反应,可用化学试纸及生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为________。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② |
|||
| ⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是,②元素的氧化物的电子式是,②与⑧形成的化合物中存在的化学键是,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是(用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是(用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
①写出反应a的化学方程式:。
②写出戊与丁反应的化学方程式:。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。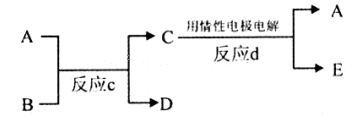
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为:。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为。
已知2A2(g)+B2(g) 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是(填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系:
(1)推断化学式:X;A;B;D。
(2)写出C→E反应的化学方程式。
(3)写出X→A反应的离子方程式(OH-足量)。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式:。
有机物A的结构简式为 ,它可通过不同的化学反应分别制得B、C、D和E四种物质。
,它可通过不同的化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是(填代号)。
(2)写出由A生成B的化学方程式和反应类型
,反应类型:。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(4)C能形成高聚物,该高聚物的结构简式为。
(5)写出D与NaOH溶液共热反应的化学方程式。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式:。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ图Ⅱ
根据上图分析:工业生产中最佳温度为℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为。