通过一年的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。
(1)写出图中标示的仪器名称:① ,② 。
(2)实验室用KMnO4制取O2,应选用的发生装置为 (填字母序号,下同),收集装置可选用 (写一种即可),取用KMnO4药品时,应选用仪器 ,写出该反应的化学方程式 。
(3)注射器C可用于检查装置E的气密性,步骤如下:
①向锥形瓶中加入少量水至 处。②将注射器C连接到装置E的导管口处。③缓慢拉动注射器C的活塞,观察到 ,表示装置E的气密性良好。
(4)实验室用装置E制取CO2时,如用注射器C替换长颈漏斗,优点是 。
小芳同学从超市购买了一瓶维生素C泡腾片。下图是标签上的部分内容。
| 维生素C泡腾片 功能:补充人体维生素C,增强机体抵抗力 主要成分:维生素C 辅料成分:碳酸氢钠、氯化钠、酒石酸晶体、蔗糖、糖精钠、阿朴胡萝卜醛、橘味香精、橙味香精、维生素B 贮藏:低温、避光、防潮 |
小芳同学根据使用说明将维生素C泡腾片放入一杯水中,发现维生素C泡腾片逐渐溶解,产生大量气泡,片刻后变为一杯鲜甜的橙味饮品。小芳同学感到很好奇,产生的气泡是什么呢?
请你参与小芳同学的探究:
【提出问题】维生素C泡腾片放入水中,产生的气泡是什么呢?
【我的猜想】气体成分是________,理由是_________________________。
【实验方案】
| 实验步骤 |
实验现象 |
实验结论 |
| 将一片维生素C泡腾片放入水中,将产生的气体通入__ __________________ |
根据维生素C泡腾片储存条件,请说明保存时要低温和防潮的原因是:
①______________________________________________________;
②______________________________________________________。
日常生活中使用的塑料袋有两种,一种是用聚乙烯制成的,另一种是用聚氯乙烯制成的。通过查阅资料知:聚乙烯完全燃烧生成CO2和H2O,而聚氯乙烯完全燃烧除生成CO2和H2O外,还有刺激性气味的气体产生,该气体极易溶于水生成盐酸,则该气体是________________。
(1)鉴别这两种塑料袋最简单的方法是________________________________。
(2)现用如图所示的实验来探究塑料燃烧的产物。实验时,若B、C两瓶都观察到明显现象,则B瓶中的现象是_____________,C瓶中的现象是___________,由此可判断A瓶中燃烧的是_____________________。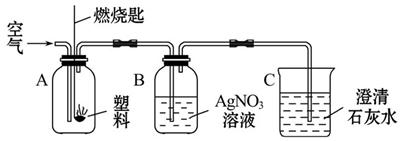
学习氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞溶液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞溶液变红色。
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞溶液,振荡 |
试管内溶液仍为无色 |
水分子不能使无色酚酞溶液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
||
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是__________________________。
实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有_________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如图装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是__________________,发生反应的化学方程式为_____________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有_________(填一条化学性质)的性质。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?__________________。
在两支试管中各加入2 mL水,然后分别加入1~2小粒碘或高锰酸钾,振荡,观察现象;然后再向两支试管中分别加1 mL汽油,振荡,静置,观察现象。记录如表所示:
| 溶剂 |
溶质 |
现象 |
| 先加水 |
碘 |
底部仍有碘固体,液体呈浅黄色 |
| 先加水 |
高锰酸钾 |
底部无固体,溶液呈深紫色 |
| 再加汽油 |
碘 |
分层,上层呈深紫色,下层近无色,底部无固体 |
| 再加汽油 |
高锰酸钾 |
分层,上层无色,下层呈深紫色,底部无固体 |
请回答:
(1)加入汽油后,投入碘的试管的上层液体名称是_________;投入高锰酸钾的试管的下层液体的名称是_____________________。
(2)从实验现象可以归纳:碘的溶解性为______________,高锰酸钾的溶解性为____________________。
(3)在科学研究中,若将大量水中溶解的少量碘“富集”起来,你认为可以采取的方法是__________________。