过渡金属催化的新型碳—碳偶联反应是近年来有机合成的研究热点之一,如:
反应① 
化合物Ⅱ可由化合物合成: 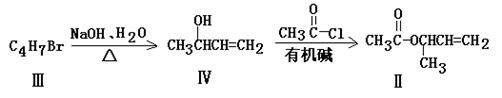
(1)化合物Ⅰ的分子式 ;化合物Ⅱ的官能团名称是 ;
(2)化合物Ⅱ与Br2加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为
(注明反应条件),
因此,在碱性条件下,由Ⅳ与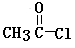 反应生成Ⅱ,其反应类型为 。
反应生成Ⅱ,其反应类型为 。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种)。
水是生命之源,也是化学反应中的主角。试回答下列问题:
A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出):
且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置。
⑵写出C、G物质的化学式,C______________ G______________
⑶写出①、④、⑥反应的化学方程式。
反应①
反应④
反应⑥
⑷写出A与水蒸气反应的化学方程式
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)  2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。
2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。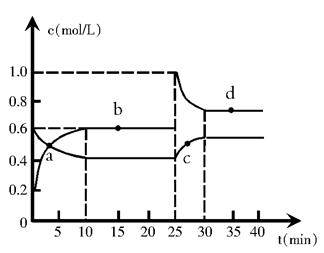
(1)该温度时,该反应的平衡常数为________________, 若温度升高,K值将__________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是____________点。从起点开始首次达到平衡时,以NO2表示的平均反应速率为______________________。
(3)25 min时,增加了______mol___________(填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度______(填“>”、“<”或“=”)0.8mol•L-1,理由是_____________________________________________________。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称),以下三种说法中,可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
(4)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。用该燃料电池电解足量的饱和食盐水,如下图所示: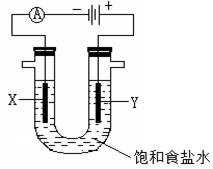
电解装置内发生反应的离子方程式为______________________________;
镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程:
请回答:
(1)MgCl2•6H2O溶于水,溶液呈(填“酸性”.“中性”.或“碱性”)。
(2)写出氨分子的电子式。
(3)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式:。
(4)轻烧后的产物为。
(5)工业获取的MgCl2•6H2O常混有FeCl3,除去MgCl2溶液中的Fe3+,可选用下列试剂
| A.MgO | B.NaOH | C.Mg(OH)2 | D.KSCN |
(6)氨化反应过程中反应的离子方程式。
(7)过滤洗涤主要是除去附着在固体表面的氯离子,过滤后洗涤沉淀的方法是;
检验沉淀已洗涤干净的方法是。