以下是我们日常生活中常用各种清洗剂,选择适当的用品可以得到更好的清洗效果。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有 的功能。
(2)以下物质可以使用洁厕灵清洗的是 填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变 色,若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应。图中a微粒的化学式为 ,在使用炉具清洁剂时应注意 (写一点即可)。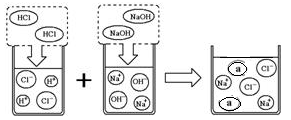
(4)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为 。
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问。(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效)。
I.查阅资料:
①漂白粉的主要成分是Ca(ClO)2、CaCl2和Ca(OH)2,其有效成分是Ca(ClO)2。
②Ca(ClO)2可溶于水,漂白原理是:它在空气中发生反应: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,
③ HClO不稳定,易分解生成HCl和一种常见的单质气体。
④ CaCl2的水溶液呈中性,HClO的水溶液呈酸性。
⑤ HClO能可使有色物质(如:品红溶液)褪色。
II.交流讨论:
该小组同学经过分析得出:HClO分解时除生成HCl外,生成的另一种常见气体是 。
III.实验探究: 下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空。
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, 。 |
。 |
漂白粉的漂白作用已完全失效。 |
IV.继续探究:同学们对某完全失效后的漂白粉的成分很感兴趣,并作进一步探究。在老师的帮助下,同学们对该失效后的漂白粉成分进行猜想:
猜想一:CaCl2和CaCO3; 猜想二: ;
小明同学认为猜想中的成分CaCO3,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示 。
小聪同学进行实验证明失效后的漂白粉的成分符合猜想一,而与猜想二不符。小聪同学的实验方案是: 。
请参与某学习小组进行研究性学习的过程,并协助完成相关任务:
[提出问题] 在平时探讨酸的性质时,我们通常是讨论酸的水溶液。究竟水在酸显示酸的特性时扮演什么角色呢?
[确定研究对象] 以我们最熟知的盐酸(氯化氢的水溶液)和氯化氢进行探究。[查阅资料] 氯化氢溶于水时解离出氢离子和氯离子,而溶于干燥的甲苯(一种有机溶剂)时仍以氯化氢分子的形式分散(如下图)。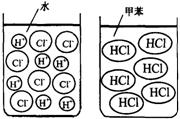
[设计与实验] (请完成下表)
| 实验内容 |
实验现象 |
解释与结论 |
| 测定导电性 |
氯化氢的水溶液:导电性良好 |
氯化氢的水溶液中有自由移动的离子 |
| 氯化氢的的甲苯溶液:A |
氯化氢的甲苯溶液中没有自由移动的离子 |
|
| 与镁作用 |
氯化氢的水溶液: B |
化学方程式: C |
| 氯化氢的甲苯溶液:没有明显的现象 |
氯化氢在甲苯溶液中没有解离出氢离子 |
|
| 与固体碳酸钠的作用 |
氯化氢的水溶液:产生气泡 |
化学方程式: D |
| 氯化氢的甲苯溶液: |
氯化氢在甲苯中没有解离出氢离子 |
[讨论与反思] 盐酸的酸性是因为氯化氢在水分子的作用下解离出了_______________E____。
小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 |
氢氧化钙溶液 |
|
| 加紫色石蕊溶液 |
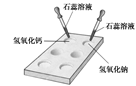
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式。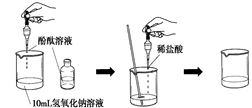
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式。
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成
为止。
这一实验说明:酸与碱作用生成了盐和水,这一反应叫做反应。中和反应的实质是;实验中滴加酚酞的作用是。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
①②
化学兴趣小组同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这半瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为①氢氧化钙;②氢氧化钙、碳酸钙;③。
(3)设计方案、进行实验:请你参与探究,并填写下表。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取样品少量于小烧杯中,加入适量水,充分搅拌,过滤。 |
||
| ②。 |
大量气泡 产生 |
氢氧化钙已经变质。 |
| ③取少量滤液于试管中,。 |
氢氧化钙没有完全变质。 该反应的化学方程式为。 |
(4)联想与启示:氢氧化钙变质是由于它与空气中的发生化学反应的缘故,因此氢氧化钙应保存。
请根据图示回答下列问题:
(1)写出图一中标号的仪器名称:①,②;
(2)某同学欲用图一装置制取氧气,可选择的物质是(填化学式),用该物质制取氧气的化学方程式为;
(3)某化学小组同学设计了气体制取与性质验证的组合装置(如图二)。打开分液漏斗活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。请看图回答下列问题:
①B中白磷能够在水下燃烧的原因是。②E中的实验现象是。
③用F装置收集气体的依据是。④ D中反应的化学方程式为。
(5分)钢铁的冶炼是人类文明的一个重要标志。图1是实验室模拟炼铁的装置图。


图一图二图三
(1)写出图1中A处发生的化学反应方程式:;
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是;(填序号)
①a点表示开始通入CO,反应开始发生
②b点表示通入CO一段时间后加热,反应开始发生
③c点表示红色粉末已充分参加反应
④d点表示反应结束后仍需继续通入CO
⑤可根据通入CO的质量计算出红色粉末的质量
(3)图1装置中的不足之处是。
(4)该实验炼制的铁与工业炼制出的铁最大的区别是。
(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了3.6g固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是。