小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
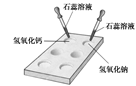
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| |
氢氧化钠溶液 |
氢氧化钙溶液 |
| 加紫色石蕊溶液 |
|
|
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式 。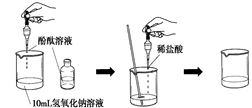
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式 。
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成
为止。
这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 反应。中和反应的实质是 ;实验中滴加酚酞的作用是 。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
① ②
(1)下图是实验室制备物质、探究物质性质的常用装置,请回答:
①仪器a、b的名称分别是;
②连接装置A、E可用来制取氧气,装置A应与E的端连接,反应的化学方程式为
;
③除去CO中少量的CO2,最好将气体通过装置,理由是;
④连接装置B、C可用来验证CO的还原性,CO通过装置B时可以看到;装置C中出现白色浑浊,那么,装置B中发生反应的化学方程式。
(2)课外学习小组为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(见下图)。
请分析实验Ⅰ、Ⅱ后回答:①实验Ⅰ反映了同种金属跟不同酸反应的剧烈程度不同;实验Ⅱ则表明了剧烈程度不同,原因是;
②按照实验Ⅰ和Ⅱ设计思路,请你再设计一组对比实验,简述实验方案。
某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红。碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题:
(1)实验Ⅰ是为了;
(2)实验Ⅱ加入蒸馏水的目的是,小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是;
(3)实验Ⅲ滴入K2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到生成。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞试液变红;
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是。
(5分)实验室常用饱和亚硝酸钠与氯化铵溶液反应制取纯净的氮气。反应的化学方程式为:NaNO2+NH4Cl=NaCl+N2+2H2O(此反应是放热反应),实验装置如图4所示。试回答: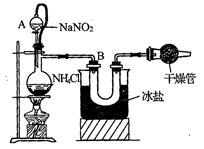
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是(填编号)
A.防止NaNO2饱和溶液蒸发
B.保证实验装置不漏气
C.使NaNO2饱和溶液容易滴下
(2)B部分的作用是(填编号)
A.冷凝
B.冷却氮气
C.缓冲氮气流
(3)加入药品前必须进行的一个实验步骤是,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是
(4)收集N2最适宜的方法是(填编号)
A.用排气法收集在集气瓶中
B.用排水法收集在集气瓶中
C.直接收集在气球或塑料袋中
四位同学用不同方法配制5%的氯化钠溶液:
甲:用固体氯化钠和水
乙:用20%的氯化钠溶液加水稀释
丙:用粗盐(含有少量泥沙的氯化钠)和水
丁:用100g20%的氯化钠溶液、10g氯化钠固体和水
(1)实验中四位同学共同用到的实验仪器有、
(2)甲称量氯化钠时,指针向左偏转,则应(填序号)
A.增加砝码 B.移动游码
C.取出一些NaCl固体 D.再加一些NaCl固体
若甲同学最后配得的氯化钠溶液溶质的质量分数小于10%,可能的原因是
①用量筒量取水时仰视读数
②配制溶液时烧杯用少量蒸馏水润洗
③在托盘天平的左盘称量氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯
A.①②③④⑤ B.①②④⑤ C.①②③ D.②③④⑤
(3)乙配制100g溶质质量分数为5%的溶液时应量取ml的水。
(4)丙应进行的实验步骤是(填序号)。
①溶解②过滤③蒸发结晶④计算⑤装瓶并贴标签⑥称量
假设需粗盐50g,最好应量取ml水来溶解(20℃、SNaCl=36g)
(5)丁用100g20%的氯化钠溶液、10g氯化钠固体和水可配制成5%的氯化钠溶液g。
燃烧是生活中常常见到的现象,氧气具有支持燃烧的性质。(提示:假设蜡烛中不含氧元素)


硫的燃烧蜡烛的燃烧铁丝的燃烧
(1)上述三个实验的共同点是(填序号);
①都有光或火焰产生②都放热③生成物都为固体
④都是化合反应⑤都是氧化反应⑥生成物都是氧化物
(2)硫燃烧实验中水的作用是;
(3)铁丝燃烧的化学反应式为;
(4)从化学反应前后氧元素化合价的变化分析,氧气在上述反应中具有氧化性的原因是。
【提出问题1】只有氧气才能支持燃烧吗?
(提示:钠是一种银白色金属。)
【设计实验一】向盛有Na的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成。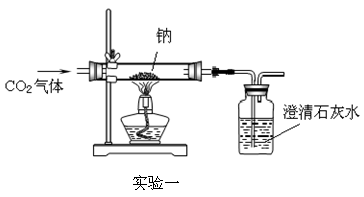
【得出结论】二氧化碳(“能”或“不能”)支持燃烧。
【提出问题2】黑色颗粒和白色物质是什么?
【探究活动】探究黑色颗粒的成分
【猜想与假设】同学们猜想黑色颗粒成分可能是。
【设计并进行实验二】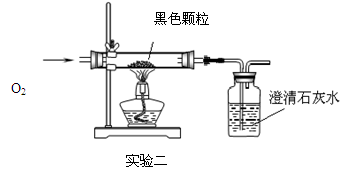
实验过程,观察到黑色颗粒逐渐减少,澄清石灰水变浑浊.
【得出结论】实验二证明同学们的猜想是正确的。硬质玻璃管内发生反应的化学反应式为。
[探究活动]探究白色物质的成分
【猜想与假设】同学们对白色物质的成分做出以下猜想:Ⅰ是碳酸钠;Ⅱ是氢氧化钠。
你认为猜想(填序号)一定是错误的,理由是。
通过实验证明,另一猜想正确。
反应物中没有氢元素
【得出结论】钠与二氧化碳反应的化学反应式为。