芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: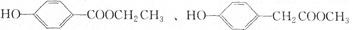 ,___________、___________。(写两种即可)
,___________、___________。(写两种即可)
(4)现有C和E的混合物n mol。在空气中完全燃烧消耗O2___________L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为:______________________ 。
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)反应III中氧化剂与还原剂的物质的量之比为。
(2)反应Ⅳ的化学方程式为。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为。
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 |
Cu Ag Au Se Te |
| 百分含量/% |
23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| 固定浸出温度 |
固定H2SO4浓度 |
|||
| H2SO4浓度 mol/L |
浸出率/% |
浸出温度/℃ |
浸出率/% |
|
| Cu Ag Au Se Te |
Cu Ag Au Se Te |
|||
| 4 |
95.1 4.67 <0.2 0.83 8.93 |
30 |
87.1 4.58 <0.2 0.08 6.83 |
|
| 3 |
94.5 4.65 <0.2 0.28 6.90 |
40 |
94.5 4.65 <0.2 0.28 6.90 |
|
| 2 |
78.1 2.65 <0.2 0.05 2.85 |
50 |
96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为;此过程中H2O2溶液的添加量要远远高于理论值,原因为。
(5)步骤Ⅵ中所发生反应的化学方程式为。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸B.浓盐酸C.浓氢氡化钠溶液D.王水
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol |
0 |
1 |
2 |
3 |
4 |
| N2 |
2.0 |
1.83 |
1.7 |
1.6 |
1.6 |
| H2 |
6.0 |
5.49 |
5.1 |
4.8 |
4.8 |
| NH3 |
0 |
0.34 |
0.6 |
0.8 |
0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0B.a=4、b=12、c=0
C.a=0、b=0.c=4D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。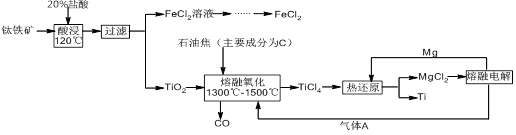
(1)请写出FeTiO3与稀盐酸反应的离子方程式:。
(2)请写出“熔融氧化”的化学方程式:。
(3)电解氯化镁的阴极反应式为:,可循环利用的物质为:(填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂:(填“能”或“不能”);原因为:。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是(填化学式)。
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2= −41kJ/mol
CO(g)+3H2(g)=CH4(g)+H2O(g)ΔH3= −206kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式。
II. 对以上反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2= −41kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2(g)+H2(g) ΔH2= −41kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 |
容器体积/L |
温度/°C |
| ① |
2.0 |
1200 |
| ② |
2.0 |
1300 |
| ③ |
1.0 |
1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n(H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)