煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ΔH 3 = −206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 |
容器体积/L |
温度/°C |
| ① |
2.0 |
1200 |
| ② |
2.0 |
1300 |
| ③ |
1.0 |
1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空: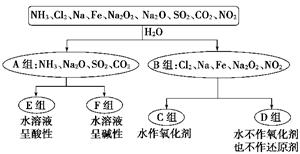
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。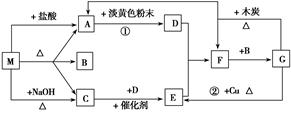
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_______________________________________________。
(4)F→G的化学方程式___________________________________________。
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,
写出该电解池的电极反应式
阳极: __________________________阴极:________________________________
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,写出该反应的离子方程式。
(2)B→C的反应类型是______________________________________。
(3)写出D→E的化学方程式: _____________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:___________________________。
(5)下列关于G的说法正确的是_________。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
(6)E的同分异构体很多,除E外符合下列条件的共种。
①含苯环且能与氯化铁溶液显色,
②苯环上有两个取代基,
③含酯基。
(7)F分子中有种不同化学环境的氢原子。
(10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为,_________。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子mol。
②湿式氧化法的流程如下图:
上述流程中制备Na2FeO4的化学方程式是:。
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)

(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为____________。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则①C的化学式为________________。
②反应B+A→C的离子方程式为____________________________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中 ________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
________7(填“﹥”“﹤”“=”)。若图c符合事实,则其pH变化的原因是_____________(用离子方程式表示)。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________。