实验室做乙醛和银氨溶液反应的实验时:
(1)为了得到光亮的银镜,试管应先用 溶液煮沸,倒掉煮沸液体后再用蒸馏水将试管冲洗干净。
(2)配制银氨溶液时向盛有 溶液的试管中逐滴滴加 溶液,边滴边振荡,直到 为止。有关反应的化学方程式为:① ;② 。
(3)加热时应用 加热。产生银镜反应的化学方程式 。
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,
其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
| A.电极b是正极,内电路中O2-由电极b流向电极a |
| B.电极a的反应式为:CH4 +4O2--8e-=CO2 +2H2O |
| C.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D.当固体电解质中有1 mol O2- 通过时,电子转移2 mol |
铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置,铝离子的结构示意图为。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是(填字母序号)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对。 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
Ⅰ对;Ⅱ错。 |
| C |
铝粉可以和氧化铁粉末发生铝热反应 |
铝热反应是工业炼铁最常用方法 |
Ⅰ对;Ⅱ错。 |
| D |
铜在潮湿空气中表面会生成铜绿 |
可用铜容器盛放浓硫酸 |
Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________(填化学式)。
为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g)∆H1="-566" kJ∙mol-1
②2NO(g)+2CO(g) ⇋ N2(g)+ 2CO2(g)∆H2="-746" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_______________。
(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染。原理如图所示。
电源正极为(填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为g。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,需进行的实验是__________。
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为(简要表述计算过程)__________。
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示: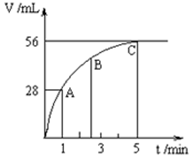
(1)该反应还可用____________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________。试解释反应速率变化的原因是___________________。
(3)该H2O2水溶液的物质的量浓度为____________________。