已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题: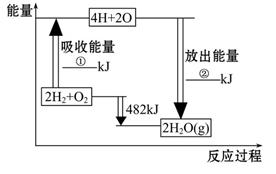
(1)分别写出①②的数值:
①___________KJ; ②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)====H2O(g)
ΔH =" +44" kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程______________________。
氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液。试回答下列问题:
(1)通入氯气的电极是__________极(填“正”或“负”);
(2)铝电极是__________极(填“正”或“负”);
(3)电子从__________(填“Al”或“Cl2”,下同)电极流向__________的电极。
金属的腐蚀是指金属与周围接触到的气体或液体物质发生________而引起损耗的现象。金属腐蚀的本质是________________,发生________反应。一般可分为________腐蚀和________腐蚀。
在医疗上常使用一种热敷袋,袋内盛装的主要成分是:铁屑、碳粉、木屑、食盐、水等。热敷袋使用之前用塑料袋封装,使之与空气隔绝。使用时,打开塑料袋让空气进入,轻揉热敷袋,就会放出热量。使用完后,会发现袋内有许多铁锈生成。试填写下列空白:
(1)热敷袋放出的热量来源于_____________________________。
(2)铁屑、碳粉、食盐、水混合后,发生化学变化的原理是_____________________。
(3)写出使用热敷袋的过程中发生的电极反应式和有关的化学方程式:
负极:____________,正极:____________,总反应:___________________。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。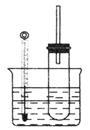
实验操作I:在试管中加入5mL1mol/LNaOH溶液和5mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是________________________。
(2)观察到___ _现象时,表明溴乙烷与NaOH溶液已完全反应,写出发生的反应方程式:
(3)鉴定生成物中乙醇的结构,可用的波谱是____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
(1)在下列物质中是同系物的有___________;互为同分异构体的有___________,是同一种物质的有___________。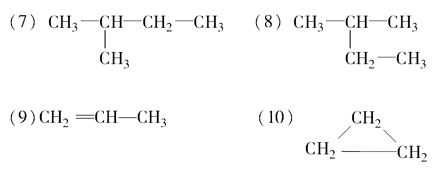
(11)2,2-二甲基丁烷
(2)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论。
如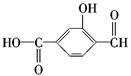 具有三种官能团:__________、__________和__________(填官能团的名称),所以这个化合物可看作__________类、__________类和__________类。
具有三种官能团:__________、__________和__________(填官能团的名称),所以这个化合物可看作__________类、__________类和__________类。