下表是元素周期表的一部分,针对表中①一⑨元素,填写下列空白。
 主族 主族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
① |
② |
③ |
|
|
| 三 |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
⑨ |
(1) ④的原子半径比⑤的原于半径____________ (填“大”或“小”)。
(2) ⑧的原子结构示意图为______________________。
(3) ①、②、③的非金属性依次________________(填“增强”或“减弱”)。
(4) 由氢与⑦所形成的化合物的分子式是___________________。
(5) ④、和⑥的氧化物对应的水化物中碱性较强的是___________(写化学式)。
27.下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: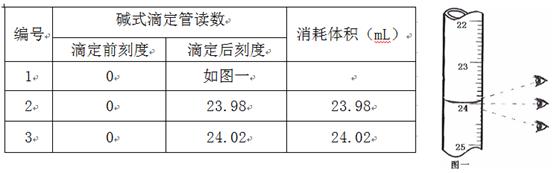
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
26.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
25.发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g)ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g)ΔH =" +23.4" kJ·mol-1
NH3(g)ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH =。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
24.常温下有0.1 mol·L-1四种溶液NaOH、NH3·H2O、HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为,由水电离的c(H+)=mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线,a、b两点中,导电能力更强的是。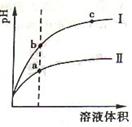
(3)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(用离子方程式表示)。此时,该混合溶液中的微粒浓度关系正确的是。
| A.c(Cl-)>c(H+) >c(NH4+)>c(OH-) |
| B.c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.c(NH4+)+ c(NH3·H2O)= 0.1mol·L-1 |
| D.c(H+) = c(NH3·H2O)+c(OH-) |
(4)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH=,该混合液中加入少量的酸或碱,结果发现溶液的pH变化不大,其原因是。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
23.能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH;
CH3OH(g) ΔH;
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①根据表中数据可判断ΔH0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:,随着反应的不断进行溶液的pH(填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为mL(标况下)。