甲酸甲酯水解反应方程式为:


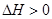
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: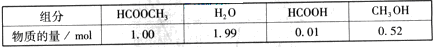
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图: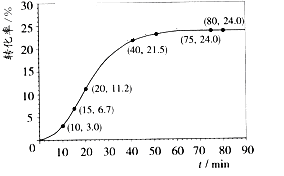
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,推测该反应在10~40分钟间反应速率较快的原因: 。
常见的染发剂可分为、、等三大类。
生活垃圾一般可以分为、、;
(9分)某烃类化合物A的质谱图表明其 相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ▲ ;
(2)A中的碳原子是否都处于同一平面? ▲ (填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。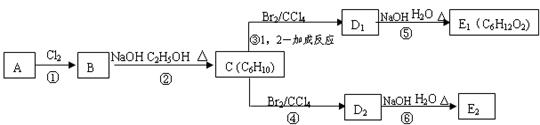

反应②的化学方程式为 ▲ ;C的化学名称为▲;
E2的结构简式是 ▲ ;④、⑥的反应类型依次是 ▲
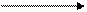 。
。
(7分)A、B、C、D四种烃分子中均含有8个氢原子,其中A、B常温下呈气态, C 、D呈液态。
(1)A是符合上述条件中相对分子质量最小的,则A的分子式为 ▲;
(2)B属于链 状单烯烃,且与HBr加成的产物只有一种,试写出B与HBr反应的化学方程式 ▲。
状单烯烃,且与HBr加成的产物只有一种,试写出B与HBr反应的化学方程式 ▲。
(3)C属于芳香烃,1mol C最多能和3molH2加成,试 写出C的结构简式 ▲。
写出C的结构简式 ▲。
(4)已知: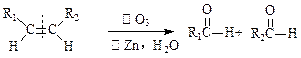 ;
;
烃D存在如下转化关系: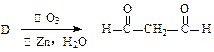 (唯一
(唯一 产物)
产物)
试写出D的结构简式 ▲。
(8分)有人设想合成具有以下结构的烃分子.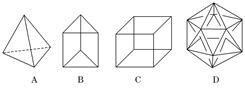
(1)结构D显然是不可能合成的,原因是 ▲.
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,金刚烷的分子式为 ▲
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是 ▲
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相 等 d.能发生取代反应和加成反应
等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异构体是生产某塑料的单体,写出合成该塑料的化学方式 ▲