如图示的原电池中, 
(1)铜极为原电池的 (填“正”或“负”)极,该极的电极反应式是 ,属于 (填“氧化反应”或“还原反应”)。
(2)如铁棒质量减轻5.6 g,则另一极放出气体的体积为 L(标准状况)。
乙酸是食醋的主要成分,它具有以下化学性质:
(1)可使紫色石蕊试液变______色,说明乙酸具有______性。
(2)能发生酯化反应。实验室用下图所示装置制取乙酸乙酯,请写出该反应的化学方程式 。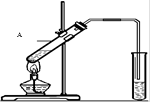
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线: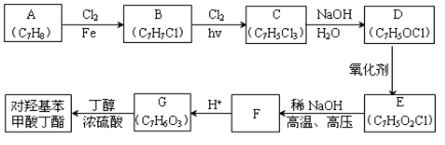
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1。
回答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有 种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是 (写结构简式)。
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下: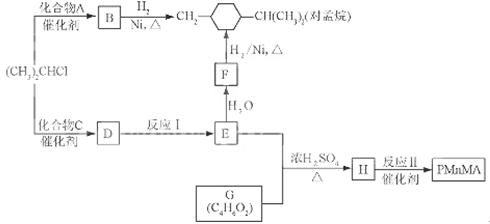
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如: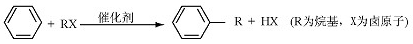
(1)B为芳香烃。
①由B生成对孟烷的反应类型是 。
②(CH3)2CHCl与A生成B的化学方程武是 。
③A的同系物中相对分子质量最小的物质是 。
(2)1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色.
①F的官能团是 。
②C的结构简式是 。
③反应I的化学方程式是 。
(3)下列说法正确的是(选填字母)
a.B可使酸性高锰放钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。G与NaHCO3反应放出CO2。反应II的化学方程式是 。
沐舒坦(结构简式为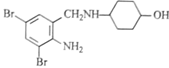 ,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)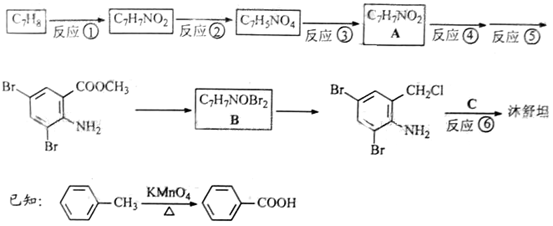
完成下列填空:
(1)写出反应试剂和反应条件。反应① 反应⑤ 。
(2)写出反应类型。反应③ 反应⑥ 。
(3)写出结构简式。A B 。
(4)反应⑥中除加入反应试剂C外,还需要加入K2CO3,其目的是为了中和 。
防止 。
(5)写出两种C的能发生水解反应,且只含3种不同化学环境氢原子的同分异构体的结构简式。
(6)反应②,反应③的顺序不能颠倒,其原因是 、 。
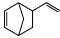 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体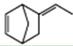 。
。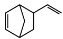 由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是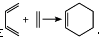
完成下列填空:
(1)Diels-Alder反应属于 反应(填反应类型):A的结构简式为。
(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称;写出生成这两种一溴代物所需要的反应试剂和反应条件。
互为同分异构体,且一溴代物只有两种的芳香烃的名称;写出生成这两种一溴代物所需要的反应试剂和反应条件。 (3)B与Cl2的1,2—加成产物消去HCl得到2—氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH)聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。
(3)B与Cl2的1,2—加成产物消去HCl得到2—氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH)聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。
(4)写出实验室由 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备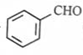 的合成路线,(合成路线常用的表示方式为:
的合成路线,(合成路线常用的表示方式为: 目标产物)
目标产物)