A、B、C、D四种芳香族化合物的结构简式如下所示: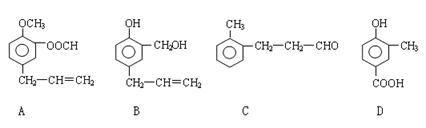
请回答下列问题:
(1)写出A中无氧官能团的名称_____________________;D中含氧官能团的结构简式为
______________________________。
(2)用A、B、C、D填空:能发生银镜反应的有 ;既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,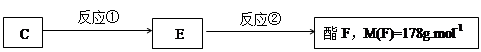
则反应①的反应类型为 ;写出反应②的化学方程式: 。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H都是苯的二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连 。
写出G和H的结构简式:G: ;H: 。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为: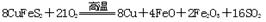
若CuFeS2中Fe的化合价为+2,反应中被氧化的元素是(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是(填代号)。
| A.高空排放 | B.用于制备硫酸 | C.用纯碱溶液吸收制Na2SO4 | D.用浓硫酸吸收 |
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为: ①用稀盐酸浸取炉渣,过滤。 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为。
证明炉渣中含有FeO的实验现象为。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: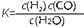 它所对应的化学反应为:
它所对应的化学反应为:
(2)已知在一定温度下,
①C(s)+CO2(g)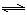 2CO(g)平衡常数K1; ①CO(g)+H2O(g)
2CO(g)平衡常数K1; ①CO(g)+H2O(g)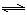 H2(g)+CO2 (g)平衡常数K2;
H2(g)+CO2 (g)平衡常数K2;
③C(s)+H2O(g)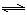 CO(g)+H2 (g) 平衡常数K3;
CO(g)+H2 (g) 平衡常数K3;
则K1、K2、K3之间的关系是:。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水
蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) 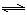 H2(g)+CO2(g),该反应平衡常数随温度的
H2(g)+CO2(g),该反应平衡常数随温度的
变化如下表所示:
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 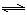 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。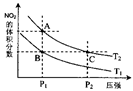
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式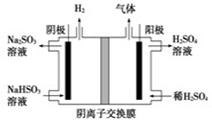
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是(填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式
。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为__________________。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为_______________________________________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是____________________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,CO32-移向电池的
(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3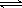 HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是(用离子方程式和必要的文字说明)。
(7分)工业上从海水中提取溴可采用如下方法:
(1)向预先经过酸化的浓缩海水中通入Cl2,将海水的溴化物氧化,反应的离子方程式为:______________________________________。
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,生成NaBr、NaBrO3和CO2,反应的化学方程式为:______________________________________。
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂萃取溴,还可以得到副产品Na2SO4,写出这一变化的离子方程式
__________________________________________。
(4)这样得到的溴中还混有少量Cl2,怎样除去?
_________________________________________________。