某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。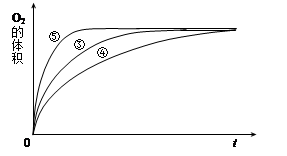
分析上图能够得出的实验结论是______________________________________。
下表为元素周期表短周期的一部分请回答下列问题: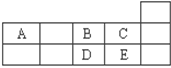
(1)A与B形成的阴离子可能有----------------------------------。(填化学式)
(2)五种元素形成的气态氢化物中最稳定。(填化学式)
(3)写出D的氢化物在过量的B中燃烧的化学方程式___________________________。
(4)写出由A、B两种元素形成的非极性分子的电子式。A、E两元素形成化合物的空间构型为_____________。
A、B、C、D、E、F、G均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。

|
|

 ,请回答下列问题:
,请回答下列问题:
针对下表中的9种元素,用化学用语回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 1 |
① |
||||||
| 2 |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)、写出⑧的原子结构示意图:_____________________________
(2)、形成物质种类最多的元素是____________________________
(3)、用电子式表示①和⑨形成化合物的过程____________________________
(4)、⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是____________________________
(5)、工业上冶炼⑥的单质选用的方法是 ____________________________
(6)、写出⑦的单质与三氧化二铁反应的化学方程式____________________________
(7)、写出③和⑧的最高正价氧化物对应水化物的浓溶液与一种结构为平面正六边形分子式为C6H6的物质反应的化学方程式:____________________________
下表是元素周期表的一部分,请依据该表回答问题。
| 族 周期 |
IA |
0 |
||||||
| 1 |
H |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
He |
| 2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)下列说法正确的是
| A.可用于半导体材料的元素是碳 |
| B.PH3的稳定性比H2S强 |
| C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H2SiO3的酸性比H3PO4弱 |
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是_______________,该元素与同周期IA族元素组成的化合物类型是。_______________
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是_______________(填化学式,下同);碱性最强的是 _______________;具有两性的是_______________。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。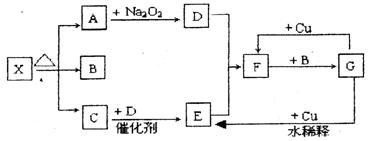
(1)写出下列各物质的化学式:
X:;B:;F:;G:。
(2)写出下列变化的反应方程式:
A→D:;
G→E:。
(3)实验室里,常用加热的混合物的方法制取气体C,常采用法来收集。