某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: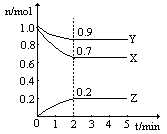
(1)图中X曲线代表 (填化学式);
(2)从开始至2min,NH3的平均反应速率是 ;
(3)第4分钟时下列叙述正确的是 ;
| A.该反应已停止 |
| B.单位时间内氮气的消耗速率等于氢气的生成速率 |
| C.3v(H2)=2v(NH3) |
| D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2 |
(4)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2与3mol H2反应完全转化为NH3应_________热量(填“吸收”或“放出”) kJ。
标准状况下,向100mLNaOH溶液中慢慢通入CO2气体充分反应后,在所得溶液M中逐滴加入1mol/L盐酸,(反应前后溶液体积变化忽略不计)所得气体体积和所加盐酸的体积关系如图。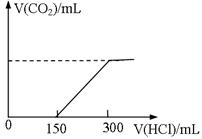
(1)c(NaOH)=
(2)取M溶液40mL与等体积的1mol/L盐酸按各种可能方式混合,产生气体的体积为VmL,则V的取值范围为。
A、B、C是常见短周期元素的单质,常温下D为无色液体 ,E是一种常见的
,E是一种常见的
温室气体。其转化关系如图所示(反应条件和部分产物略去)。试回答: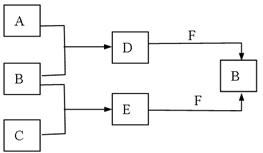
(1)F的电子式为;
(2)少量的金属单质铝与D和F混合,写出反应的离子方程式。
(3)D2mol、E 2mol与3molF在密闭容器中充分反应,所得固体成分为;其相应的物质的量为。
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为
-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是 __________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方
向和数目:
KOCN+KOH+Cl2 → CO2+N2+KCl +H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯g。
(7分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO 3 3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
| A.CO2+H2O +2NaClO=Na2CO3+2HClO |
| B.CO2+H2O +NaClO=NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5Ona
NaHCO3+C6H5Ona
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH②CH3COOH③HCN④HClO⑤H 2SO4⑥HClO4
2SO4⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出N aCl晶体根据上述反应,总结出复分解反应发生的另一规律:;
aCl晶体根据上述反应,总结出复分解反应发生的另一规律:;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是,
请写出反应的离子方程式:。
(12分)近年来,我国科学家对有机物的“自由基”的研究有新的突破,在国际上占有领先的地位。有机物中常见的最简单的自由基是碳烯(:CH2),它十分活泼,很容易用它的两个未成对电子与不饱和烃反应,生成三碳环;也可以插在烷基的碳氢键(C—H)之间,使碳链增长。请回答下列问题:
(1)写出碳烯的电子式
(2)写出碳烯与丙烯反应产物的结构简式
(3)碳烯与烃A反应,生成烃B,一定量的B完全燃烧生成8.8g CO2和4.5g H2O,B分子中含有3个-CH3,且能完成下列转化关系: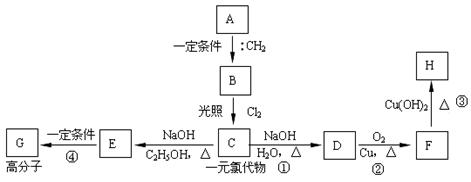
①写出A的结构简式,反应①的类型;
②写出反应③④的化学方程式:反应③;
反应④。
③H的同分异构体有多种,请写出能与NaOH溶液反应,但不与NaHCO3溶液反应的同分异构体的结构简式。