有下列几组物质:
A. H和 H和 H H |
| B.甲烷和己烷 |
| C.正丁烷和异丁烷 |
D. 和 和 |
E. 和
和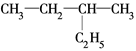
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;④属于同系物的是________________。
工业合成氨的反应N2+3H2= 2NH3的能量变化如下图所示,请回答有关问题: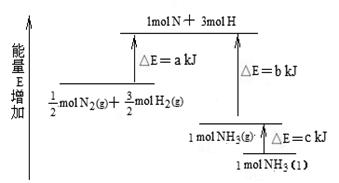
(1)合成 1 mol NH3(l) ____________(填“吸收”、“放出”)_____________kJ的热量。
(2)已知:拆开lmol H—H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ。则上图中的 a=___________kJ;1 mol N2(g) 完全反应生成NH3(g)产生的能量变化为 ______KJ。
(3)推测反应 2NH3(l)= 2N2 (g)+3H2(g) 比反应2NH3(g)= 2N2 (g)+3H2(g)_____________(填“吸收”、“放出”)的热量____________(填“多”、“少”)。
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y 元素的名称______________;
(2)W 在元素周期表中的位置是第____________周期第____________族;
(3)X2M2中存在的化学键有___________、____________;
(4)Z、W氢化物的稳定性顺序为__________________;
已知:某原电池的总反应为:2Fe3++Cu===2Fe2++Cu2 +。则:
(1)该原电池的负极材料为_______________,该电极上所发生的反应是___________________;
(2)该原电池的正极材料可为______________,该电极上所发生的反应是___________________
(3)若负极质量减少 1.28 克,那么电路中转移的电子数为___________________。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语填空回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最活泼的非金属元素是化学性质最不活泼元素原子的原子结构示意图为;
(2)元素的最高价氧化物对应的水化物中酸性最强的是,呈两性的氢氧化物是;
(3)最强碱的电子式为:_____________①的气态氢化物的电子式:_____________________
非金属单质A经如下图所示的过程转化为含氧酸D,
已知D为强酸,请回答:
(1)若A常温下为 淡黄色固体,B是有刺激性气味的无色气体。
淡黄色固体,B是有刺激性气味的无色气体。
①画出A的原子结构示意图:。
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为:。
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为:。
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式。
②C→D的反应中氧化剂与还原剂物质的量之比为:
③写出A与H2反应产物的结构式: