金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速。完成下列填空:
(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是: ;
(2)硅与铝同周期。地壳里硅、铝的含量硅 铝(填>,<或=)。SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。钠长石(NaAlSi3O8)的氧化物形式 ,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由此可推知钙长石的化学式为 ;
(3)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是 和 。
【化学—选修2:有机化学基础】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_____________(填两种物质的名称),其净水作用的原理是_________________________。
(2)水的净化与软化的区别是____________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_______________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
(5)如图是电渗析法淡化海水的原理图。其中,电极A接直流电源的正极,电极B接直流电源的负极。
①隔膜A是_________离子交换膜(填“阴”或“阳”)。
②某种海水样品,经分析含有大量的Na+,Cl-,以及少量的K+,SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
请回答下列问题:
(1)B点时剩余固体的化学式是____________。
(2)加热至A点时反应的化学方程式为______________________________。
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式____________________。
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为_______________。
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:
①A为电源___________极,阳极区溶液中发生的氧化还原反应为________________________。
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为__________mol·L-1。{已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。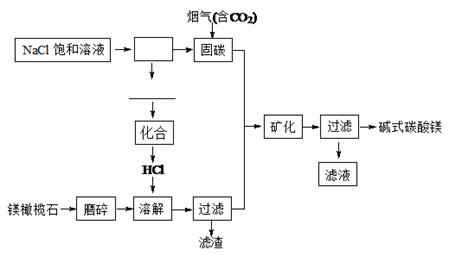
(1)上图方框里的操作名称是,横线上的物质有(填化学式)。
(2)下列物质中也可用作“固碳”的是(填字母序号)。
| A.CaCl2 | B.NH3·H2O |
| C.Na2CO3 | D.H2O |
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因。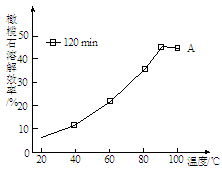
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是。本流程中可循环利用的物质是(填化学式)。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为。
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义。如硫化氢可经过一系列反应制得硫酸:
(1)物质发生不完全燃烧时的反应热难以通过实验测得。已知硫化氢气体的燃烧热是586 kJ/mol,固体硫单质的燃烧热是297kJ·mol-1。写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式。
(2)工业生产中硫化氢尾气可用NaOH溶液吸收。
①吸收尾气后得到的Na2S溶液显性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)_________。
| A.H2S+OH—=HS—+H2O | B.HS—+H2O=H2S+OH— |
C.HS—+H2O S2—+H3O+ S2—+H3O+ |
D.S2—+H2O H2S+2OH— H2S+2OH— |
(3)在一定温度下,某容器中发生2H2S(g) 2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
 时间 时间物质 |
0 min |
20 min |
60 min |
90 min |
120 min |
| H2S |
0.006 |
0.005 |
|||
| H2 |
0 |
0.002 |
0.004 |
||
| S2 |
0 |
0.002 |
0.0025 |
①判断90 min时反应速率v(正)______v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=_________。
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为_____________。
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图。