碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②平衡时容器内N2的浓度是 mol·L-1。
③SiCl4(g)的转化率是 。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g) C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(C8H10)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(C8H8)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是______。
(2)该温度下,该反应的化学平衡常数是_______________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且该反应(填序号①“向生成C8H10方向移动”、②“向生成H2方向移动”或③“平衡不移动”)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
D、T℃时,当c(C8H10):c(C8H8):c(H2)=1:1:1反应达到平衡。
(1)常温下,物质的量浓度都为0.1 mol·L-1的氨水与氢氧化钠溶液,分别加水稀释x倍和y倍,稀释后pH都为9。则x y(填“大于”、“小于”或“等于”)
(2)常温下,体积可变容器,充入SO3一段时间后反应2SO3(g) 2SO2(g)+O2(g)达到平衡状态,在恒压条件下,再充入一定量SO3一段时间后反应达到新平衡,新平衡中SO3的浓度(填“增大”、“减少”或“不变”)
2SO2(g)+O2(g)达到平衡状态,在恒压条件下,再充入一定量SO3一段时间后反应达到新平衡,新平衡中SO3的浓度(填“增大”、“减少”或“不变”)
(3)化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示。电源正极为(填A或B),阴极反应式为。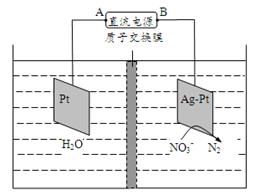
(4)在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如图: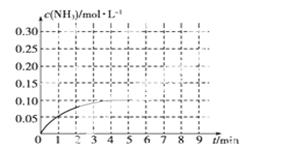
反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1②0.12 mol·L-1③0.10 mol·L-1④0.08 mol·L-1
观察下列装置,回答下列问题: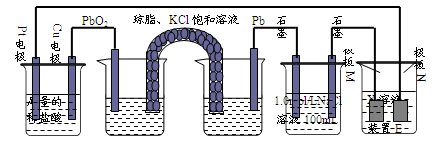
(1)装置B中PbO2上发生的电极反应方程式为。
(2)装置A中总反应的离子方程式为。
(3)若装置E中的目的是在Cu材料上镀银,则X为,极板N的材料为。
极板M处的电极反应式为__________________。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为L(标准状况下,不考虑气体的溶解)。
(1)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。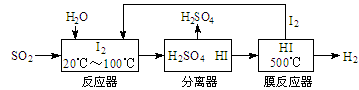
已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为。
该循环工艺过程的总反应方程式为。
(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为。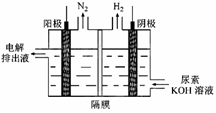
(3)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH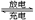 Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为。
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下: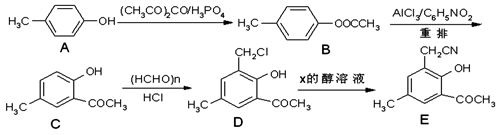
(1)A→B的反应类型为。
(2)C的核磁共振氢谱有个峰。
(3)D→E的反应中还生成了NaCl,则X的化学式为。
(4)写出同时满足下列条件的D的同分异构体的结构简式:(任写一种)。
(1)A→B的反应类型为。
(2)C的核磁共振氢谱有个峰。
(3)D→E的反应中还生成了NaCl,则X的化学式为。
(4)写出同时满足下列条件的D的同分异构体的结构简式:(任写一种)。
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN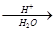 R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:。
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:。
(6)写出以对甲酚和乙醇为主要原料制备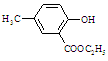 的合成路线流程图,(无机试剂任用)。流程图示例如下:
的合成路线流程图,(无机试剂任用)。流程图示例如下:
CH3CH2OH 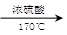 H2C=CH2
H2C=CH2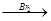 BrH2C-CH2Br
BrH2C-CH2Br