氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的 化学键键 (填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:
3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| |
N2 |
H2 |
NH3 |
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
①判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 。
(8分)某固体混合物可能由KCl、NaNO3、K2SO4、FeCl3、CaCl2、K2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验:
(1)混合物中加入足量水得到无色透明溶液;用铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色;
(2)上述溶液中滴加BaCl2有白色沉淀产生;
(3)过滤,然后向上述白色沉淀中加盐酸时,沉淀全部溶解;
(4)往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸。
试判断:肯定存在的物质有____________;肯定不存在的物质有_______________________;可能存在的物质有______________________;写出第(4)步实验中发生反应的离子方程式:_____________________。
(12分) 下面是元素周期表的简略框架图。
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
按电子排布,可把元素划分成5个区,不全是金属元素的区为__________。
(2)上表中元素①、②原子的最外层电子的电子排布式分别为、;比较元素①与元素②的下列性质(填写“>”或“<”)。
原子半径:①_______②、电负性:①_______②、金属性:①_______②。
(3)某短周期元素最高正价为+7,其原子结构示意图为_____________。
(4)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的___________族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实。
短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号;B的元素名称;
(2)D的原子的电子式;C原子的电子排布式。
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序是。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是。
如图所示的甲、乙、丙三种晶体:
(1)甲晶体的化学式(X为阳离子)为________
(2)乙晶体中A、B、C三种微粒的个数比是________
(3)丙晶体中每个D周围结合E的个数是________个。
(12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。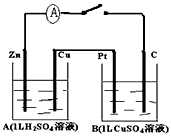
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________