在相同温度时100 mL 0.01mol/L的醋酸溶液与10 mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.电离程度 |
| C.H+的物质的量的量浓度 | D.CH3COOH的物质的量 |
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
已知某酸H2B在水溶液中存在下列关系:①H2B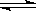 H++HB-,②HB-
H++HB-,②HB-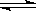 H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是( )
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是( )
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是( )
| A.该温度高于25℃ |
| B.水电离出的c(H+)=1×10-10 mol/L |
| C.c(H+)=c(OH-)+c(SO42-) |
| D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性 |
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
| A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗 |
| C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 |
| D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |
下列各选项中所述的两个量,前者一定大于后者的是( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |