以NA代表阿伏伽德罗常数,则关于热化学方程式C2H2(g)+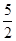 O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
| A.当12NA个电子转移时,该反应放出1300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当有2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
佛山随着私家车的不断增多,汽车尾气对环境的污染成为人们关注的焦点,下列不属于汽车尾气中所含主要化合物的是
| A.碳氧化合物 | B.碳氢化合物 | C.氟氯烃 | D.氮氧化合物 |
400℃时,向容积为2L的密闭容器中充入1.2 mol 的A和0.6mol 的B,发生反应如下:A(g)+B(g)  C(g)+D(g)。t分钟后反应达到平衡,此时测得A的物质的量为0.8 mol。下列说法正确的是
C(g)+D(g)。t分钟后反应达到平衡,此时测得A的物质的量为0.8 mol。下列说法正确的是
A.反应在tmin内的平均速率为v(D)=0.4/tmol·L-1·min-1
B. 温度升至500℃时,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.2molB,与原平衡相比,达到新平衡时A转化率增大,B的体积分数增大
D. 若反应开始时向密闭容器中充入2.4 mol 的A和1.2mol 的B,达到平衡所需时间小于t
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应 当溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+)时,醋酸一定过量 |
| C.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D.在0.1mol·L—1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-) |
X、Y、Z、M、W为五种原子序数依次增大短周期元素。Y、Z、M是同一周期的元素,且最外层电子数之和为15,Y与M可形成YM 2分子;X与Z形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.YM2、Y2X2、W2M2均为直线型的共价化合物 |
| C.元素Z和元素M的最高正价的数值之和等于11 |
| D.由X、Y、Z、M四种元素形成的化合物中可能含有离子键 |
已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |