山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸的性质叙述中,不正确的是( )
| A.可与钠反应 | B.可与碳酸钠溶液反应 |
| C.可与溴的四氯化碳溶液发生取代反应 | D.可生成高分子化合物 |
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)( )
| A.3种 | B.4种 | C.5种 | D.6种 |
用下图所示装置检验乙烯时不需要除杂的是( )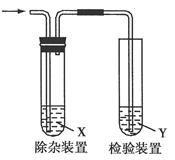

用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )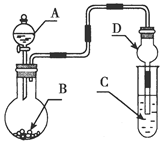
| A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色 |
| B.实验仪器D可以起到防止溶液倒吸的作用 |
| C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 |
| D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
| A.原混合溶液中c(K+)为2 mol·L-1 |
| B.上述电解过程中共转移6 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol·L-1 |