已知有机物甲、乙、丙有如下信息:
| |
甲 |
乙 |
丙 |
| 所含元素 |
C、H |
C、H、F |
C、H、F |
| 所含电子数 |
26 |
|
|
| 结构特点 |
饱和有机物 |
|
|
据此推断:
(1)甲的分子式为 ,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有 种。
(2)乙是性能优良的环保产品,可代替某些破坏臭氧层的氟利昂产品用作制冷剂。其分子中C、H、F的原子个数之比为1∶2∶2,则乙的结构简式为 。下列关于乙的叙述中正确的是 。
A. 其分子构型为正四面体型 B. 它能与溴水发生反应而褪色
C. 1 mol乙最多能与1 mol F2发生取代反应 D. 它没有同分异构
(3)将甲、乙按物质的量之比1∶1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,但丙分子不存在同分异构体,则丙的分子式为 。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的化学反应方程式_____________________________
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O=Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目___________________________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
(1)加入NaOH 0~ 20mL 时发生反应离子方程式___________________,
加入NaOH 20~ 200mL 时发生反应离子方程式___________________,
加入NaOH 200~ 240mL 时发生反应离子方程式___________________,
(2)镁和铝的总质量为________g
(3)硫酸的物质的量浓度为___________ mol/L
(4)生成的氢气在标准状况下的体积为__________L
[化学选修2——化学与技术]
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组,将一批废弃的线路析简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的所有的离子方程式为_______;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是___________,使用H2O2的优点是___________,调溶液pH的目的是使________________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
上述三种方案中,________方案不可行,原因是________________从原子利用率角度考虑,__________方案更合理。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。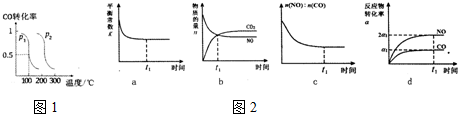
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol相关数据如下
CH3OH(g)+H2O(g) △H=-49.0kJ/mol相关数据如下
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
请回答:①c1_________c2(填“>”“<”或“=”),a=_________;
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是______mol/(L·s)-1;
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g) CH3OH(g),平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
CH3OH(g),平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于_____(填“吸”或“放”)热反应,p1_____p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=_____(用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0 ;在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是_____。
2CO2(g)+N2(g) △H<0 ;在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是_____。