下列实验能达到实验目的的是_____________。
| A.用硫酸铜溶液除去电石与水反应生成的乙炔气体中的杂质 |
| B.溴乙烷与NaOH水溶液混合共热一段时间后,向水层加入AgNO3溶液,观察到淡黄色沉淀产生。 |
C.甲苯与液溴混合,加入少量铁屑,制备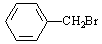 。 。 |
| D.已知3.0 mol·L-1 CuSO4溶液中Cu2+开始沉淀的pH为4,Fe3+完全沉淀时溶液的pH为3.3,则可以用氧化铜除去该溶液中含有的杂质Fe3+ |
E.只用FeCl3溶液就可以鉴别出苯酚溶液、NaOH溶液、KHCO3溶液、苯、溴乙烷五种无色液体
F.用稀盐酸和溴的四氯化碳溶液可证明1-溴戊烷在NaOH水溶液与NaOH醇溶液中发生的反应类型不同
G.通过石油的分馏可以直接得到甲烷、乙烯和苯等产品
如图所示装置:
①若烧杯中溶液为稀硫酸,
电极反应式为:正极;
负极。
②若烧杯中溶液为氢氧化钠溶液,则负极为,
总反应方程为。
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
①由图中所给数据进行分析,该反应的化学方程式为;
②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=,
③当反应进行了3 min,该反应是否达到平衡(填“是”或“否”)。
(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中
T1~T2速率变化的主要原因是____,
T2~T3速率变化的主要原因是___ ___
(13分)下表列出了A—R9种元素在周期表中的位置,用元素符号或化学式填空。
 主族周期 主族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)这九种元素中:化学性质最不活泼的是;金属性最强的是:最高价氧化物的水化物碱性最强的碱的电子式是最高价氧化物的水化物酸性最强的酸是;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
。
(3 )A、B、C三种元素按原子半径由大到小的顺序排列的为。
(4)F的氢化物的电子式;G、H 氢化物的稳定性递减的顺序是:。
(5)H元素跟A元素形成的化合物的电子式是。
(6 ) C和G两种元素形成的化合物属于(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程。
(2分)已知乳酸的结构简式为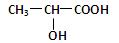 。试回答:
。试回答:
乳酸分子中含有________和_________两种官能团(写名称);
(5分) 某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则(1)此有机物的相对分子质量为____________;(2)此有机物的分子式为____________;其可能的结构简式为