实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:



图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。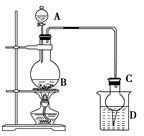
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:_____________________________________________________________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________________________________________;
反应结束后D中的现象是_______________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入________(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。已知X中铁、碳的元素质量比为14∶1。X的最简式为__________。
(2)X有下列转化关系:(无关物质已经略去)
溶液甲中含有的大量阳离子是________________;溶液甲中加入H2O2发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z__________、W__________。
(4)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们:________________________。
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下: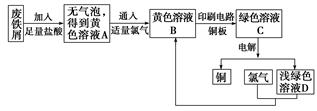
①写出废铁屑与盐酸反应的离子方程式:
________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 实验内容 |
实验操作 |
预期现象和结论 |
| 检验黄色溶液A中是否含有Fe2+ |
||
| 检验绿色溶液C中是否含有Fe3+ |
某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有
| A.大理石 | B.盐酸 |
| C.氢氧化钠溶液 | D.澄清石灰水 |
三名同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液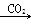 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液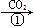 NaHCO3溶液
NaHCO3溶液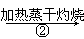 Na2CO3固体
Na2CO3固体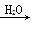 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液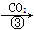 NaHCO3溶液
NaHCO3溶液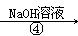 Na2CO3溶液
Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案________________________________________________________________________。
乙方案________________________________________________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有
________________________________________________________________________。
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的?________(填“能”或“不能”)。若能,请说明计算所需的数据;若不能,请简要说明理由________________________________________________________________________。
实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)加热铁屑与稀硫酸时常常需要补充蒸馏水,原因是
________________________________________________________________________。
(2)实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是________________________________________________________________________。
(3)为防止Fe2+被氧化,实验中可采取的措施是________________________________________________________________________
________________________________________________________________________。
实验室常用甲酸和浓硫酸共热制取CO,其反应如下,HCOOH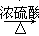 CO↑+H2O。
CO↑+H2O。
回答下列问题:
(1)其发生装置与下列气体的发生装置相同的是________。
A.NH3 B.CO2
C.Cl2 D.C2H2
(2)其收集方法与下列气体的收集方法相同的是________。
A.Cl2 B.SO2
C.NO2 D.NO
(3)从下列仪器中,选出最合适的,组装制取、净化和收集CO的装置,其中不需要的是________。
A.铁架台 B.圆底烧瓶 C.分液漏斗 D.长颈漏斗
E.玻璃导管 F.洗气瓶 G.水槽 H.双孔塞 I.酒精灯
J.石棉网
(4)尾气如何处理?________________________________________________________________________。