某厂废水中含5.00×10-3mol·L-1的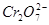 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料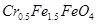 (
(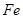 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是 ,
(1)第①步反应的离子方程式是 ,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有 ,
(4)欲使1L该废水中的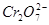 完全转化为
完全转化为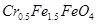 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。
A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_________,E离子的电子排布式为____________,C原子的电子排布图为,D原子的原子结构示意图为_______。
(2)B的氢化物的沸点高于同主族元素氢化物的沸点,原因是_____________,该氢化物的电子式为_______,中心原子的杂化方式为 _______,分子的立体构型为_______。
(3)DCA与E的最高价氧化物的水化物相互反应的离子方程式。
(4)根据对角线规则,Be与E性质相似,写出Be与DCA溶液反应的离子方程式______________________
(5)若要说明非金属元素X比元素Y(X、Y均为非稀有气体元素)的非金属性强,则下列方法正确的是__________(填序号)。
①X单质可以把Y从其氢化物中置换出来
②X原子的最外层电子数比Y原子的最外层电子数多
③X的氧化物的水化物的酸性比Y的氧化物的水化物的酸性强
④与H2化合时X单质比Y单质容易
⑤电负性:X>Y
(1)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________________。
(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4。
(3)根据价层电子对互斥理论判断:H2O的VSEPR构型为。
(4)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”),原因是__________
有下列几种晶体,完成下列各小题。
A干冰;B氯化钠;C冰;D水晶;E氯化铵;F晶体氖;G铝;HC60;I金刚石
(1)属于分子晶体的是,属于离子晶体的是。
(2)晶体中有氢键的是,受热熔化只需克服共价键的是________。
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。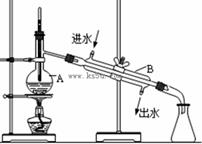
(1)图中的两处明显的错误是:________________________ ;_________________________________。
(2)B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量_______,其作用是__________________。
按要求完成下列小题.
(1)0.5 mol H2O的质量为 g,共有____________个分子,___________个电子。
(2) 0.01mol某物质的质量为1.08g,则此物质的摩尔质量为__________________。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4_____________g;需要CuSO4·5H2O _____g。
(4)如图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
①该浓硫酸的物质的量浓度_____________,
②用该浓硫酸配制200mL1mol/L的稀硫酸,量筒所需量取该浓硫酸的体积是_________mL。